Как уже указывалось, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение состояния Клапейрона—Менделеева ![]() (для моля газа) для реальных газов непригодны.
(для моля газа) для реальных газов непригодны.
Учитывая собственный объем молекул и сил межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальса (1837—1923) вывел уравнения состояния реального газа. Ван-дер-Ваальс для вывода использовал уравнение Клапейрона—Менделеева в которое ввел две поправки, учитывающие объем молекул и силы из взаимодействия.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не ![]() , a
, a ![]() , где
, где ![]() — объем, занимаемый самими молекулами. Объем
— объем, занимаемый самими молекулами. Объем ![]() равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра
равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра ![]() молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса
молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса ![]() , т. е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу — учетверенный объем молекулы.
, т. е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу — учетверенный объем молекулы.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
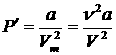 , (2.1)
, (2.1)
где ![]() — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения,
— постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, ![]() — молярный объем.
— молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
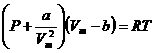 . (2.2)
. (2.2)
Для произвольного количества вещества ![]() газа
газа ![]() с учетом того, что
с учетом того, что ![]() , уравнение Ван-дер-Ваальса примет вид
, уравнение Ван-дер-Ваальса примет вид
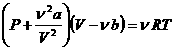 (2.3)
(2.3)
где поправки ![]() и
и ![]() — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
— постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Поможем написать любую работу на аналогичную тему

