Любой метод ДНК-диагностики основан на специфической гибридизации двух нитей ДНК, комплементарных (структурно дополняющих) одна другой. Примерной (хотя и весьма приблизительной) аналогией может служить серологическая реакция, основанная на специфической реакции белка-антитела с соответствующим антигеном. Специфичность связывания нитей в спирали ДНК основана на связях А-Т и Г-Ц. Праймеры комплементарны искомым участкам ДНК, и поэтому они способны связываться с конкретными участками гена. Достройка нитей ДНК, начиная с добавленных праймеров, требует наличия в реакционной смеси пурин- и пиримидинтрифосфатов (АТФ, ТТФ, ГТФ и ЦТФ), а также присутствия ДНК-полимеразы, которая соединяет их в цепочку согласно последовательности второй нити ДНК.
Проведению ПЦР предшествует стадия выделения и преципитации (осаждения) ДНК из исследуемого материала. Это обеспечивает концентрирование обнаруживаемой ДНК инфекционного агента в минимальном объеме жидкости, используемой в ПЦР. В случаях, когда не требуется достижения высокой чувствительности анализа, например, при идентификации микобактерии туберкулеза после первичного культивирования, достаточна их обработка, позволяющая лишь разрушить микробную стенку: нагревание в лизирующем буфере, ультразвуковая обработка или использование ферментов (лизоцим) без последующего выделения ДНК.
При отсутствии в пробе ингибиторов Taq-полимеразы (гемоглобина или других) и наличия десятка копий ДНК-матрицы в объеме, вносимом в пробирку со смесью всех реагентов ПЦР, подготовка пробы может быть полностью исключена. Например, вирус гепатита В в сыворотке крови и многие возбудители инфекционных менингитов в спинномозговой жидкости можно детектировать методом ПЦР без всякой подготовки, без предварительного выделения из них ДНК. В большинстве случаев из исследуемой пробы крови, сыворотки, лейкоцитов, биоптатов, мочи, мокроты для исключения ложноотрицательного результата следует выделить ДНК тем или иным способом. Благодаря этому происходит концентрирование исследуемой ДНК-матрицы в малом объеме и удаление ингибиторов Taq-полимеразы.
В настоящее время используется несколько способов подготовки образца для проведения ПЦР. Процедура подготовки пробы включает лизис микроорганизма и экстракцию нуклеиновой кислоты. С целью разрушения клетки используют простое кипячение, замораживание-оттаивание в присутствии лизоцима, а также специальные лизирующие буферы, содержащие детергенты и протеиназу. Выбор метода диктуется природой микроорганизма, а точнее - природой его клеточной стенки.
Для экстракции ДНК используют два основных метода. Во-первых, применяют классическую процедуру фенольно-хлороформной экстракции. При этом достигается хорошая очистка ДНК и, в первую очередь, от ингибиторов Taq-полимеразы, но неизбежны большие потери нуклеиновой кислоты, особенно заметные при работе с образцами небольшого объема с низкой концентрацией инфекционного агента. Другой способ, применяемый для очистки нуклеиновой кислоты, основан на использовании сорбентов. Подготовка материала с его использованием занимает меньше времени и более проста в исполнении, хотя не всегда может быть применена, так как не гарантирует удаление возможных ингибиторов.
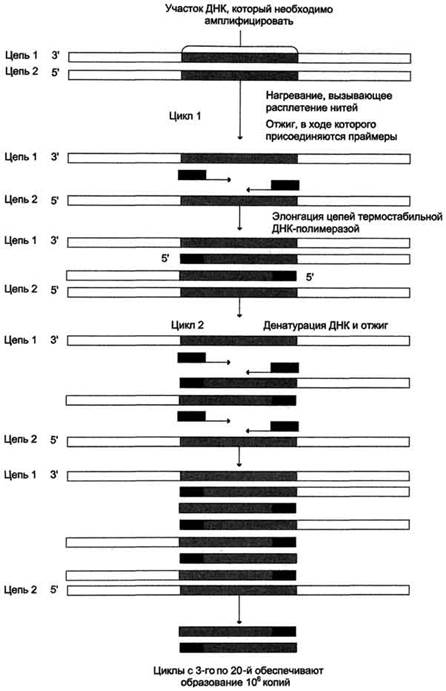
Реакционная смесь для получения интересующей нас ДНК содержит исследуемую ДНК, субстраты реакции - 4 дНТФ, 2 праймера, термостабильную, или Taq-полимеразу и буфер, содержащий ионы Mg2+.
Один цикл полимеризации включает 3 этапа:
• плавление: на этой стадии реакционную смесь нагревают до температуры 90-97 °С. Исследуемая двуцепочечная ДНК денатурирует и переходит в однонитевую форму;
• гибридизация или отжиг ДНК с праймерами. В результате снижения температуры до 50-60 °С происходит комплементарное связывание праймеров с цепями матричной ДНК и образование двухцепочечного участка на каждой из нитей ДНК;
• элонгация, удлинение нитей ДНК, комплементарных матричной ДНК, катализирует Taq-полимераза в направлении от 5'- к 3'-концу.
Затем снова наступает этап плавления, когда за счёт повышения температуры синтез ДНК прекращается, и двунитевой участок между матричными и вновь синтезированными молекулами ДНК денатурирует. Во втором и последующих циклах праймеры гибридизируются с исходной матричной ДНК и с вновь синтезированными молекулами ДНК, количество которых нарастает в геометрической прогрессии. В последнем случае синтез ДНК заканчивается не из-за изменения температурного режима, а по достижении ДНК-полиМеразой границы амплифицированного участка, что определяет строго определённый размер продукта с точностью до одного нуклеотида.
Каждый из этапов цикла имеет продолжительность от десятков секунд до 1-3 мин, в результате полный цикл длится от одной до нескольких минут.
Описанную процедуру амплификации ДНК проводят в автоматическом режиме в приборе - циклизаторе, или термоциклере, амплификаторе ДНК. Такой прибор позволяет задавать нужное количество циклов и выбирать оптимальные временные и температурные параметры. За 25-30 циклов число синтезированных копий ДНК достигает нескольких миллионов.
С помощью ПЦР можно получить достаточное количество копий участков ДНК, в которых предполагаются присутствие мутаций, полиморфизм сайтов, можно проводить ДНК-диагностику инфицированности пациентов вирусными, бактериальными и грибковыми возбудителями болезней.
Поможем написать любую работу на аналогичную тему

