Согласно современным представлениям о строении и структуре молекул нормальных парафиновых углеводородов последним приписывается зигзагообразная меандровидная конфигурация (рис. 1, 2) с постоянным тетраэдрическим углом a=109°28' между молекулярными связями СН2—CH2 и постоянным расстоянием между углеродными атомами порядка 1,54А, расположенными в одной плоскости. Из этого, однако, не следует, что алифатические молекулы можно рассматривать как плоские фигуры.
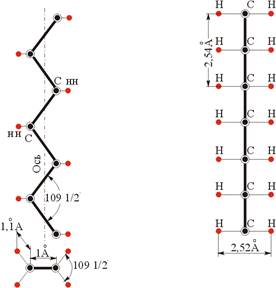 |
Рис. 1 Основные элементы и размеры схематизированной модели участка цепи молекулы парафина
С—атомы углерода, Н—атомы водорода
 |
Рис. 2 Объемная модель молекулы нормального парафина С19
1 – атомы углерода, 2 – атомы водорода
Расположенные парами в плоскостях, перпендикулярных к плоскости зигзагообразной цепи молекулы углеводорода, атомы углерода придают сечению цепи овальный вид, приближающийся к окружности с радиусом около 2,6А. Это обстоятельство обусловливает возможность осуществления различного рода колебаний цепи в целом и ее вращения даже в структуре кристалла, а также перехода в различные модификации. Общую длину цепи такой молекулы, пропорциональную числу звеньев n, можно определить из выражения l=1,27nА.
Среди нормальных парафиновых углеводородов известны и такие, которые насчитывают десятки углеродных атомов, длина молекул которых достигает 100А. Длина молекул основной части нормальных кристаллических углеводородов, выделенных из ромашкинской нефти, находится в пределах 28—40А. Характерная меандровидная форма молекул углеводородов имеет свои вполне объективные причины.
Известно, что общее число возможных конфигураций, которые может принимать линейная молекула, состоящая из n звеньев, равна 2n-1. С этой точки зрения углеводородная цепь, например, в 16 метиленовых звеньев может иметь 215 вариантов конфигураций. Как следует из конформационного анализа, наиболее устойчивой структурой молекулы, отвечающей минимуму ее потенциальной энергии, является именно меандровидная модификация, представляющая собой конпланарную зигзагообразную цепь. Причем атомы водорода, связанные с атомами углерода связями длиной 1,1А (см. рис. 1), расположены попарно четырьмя параллельными рядами, если рассматривать их в сечении, перпендикулярном к длине оси. При этом площадь сечения одной молекулы определяется величиной порядка 18.5А.
В результате теплового воздействия молекулы углеводородов могут образовывать поворотные изомеры различного типа. Это объясняется тем, что по мере повышения температуры внутримолекулярное вращение в метиленовых цепях становится все более ярко выраженным, а амплитуда вращательных колебаний звеньев цепей возрастает. К такому же эффекту приводит и увеличение длины молекул, поскольку вероятность вовлечения звеньев цепи в интрамолекулярное броуновское движение при этом увеличивается.
Способность к свободному вращению звеньев метиленовых цепей относительно отдельных атомов углерода позволяет понять механизм возникновения изомеров молекул углеводородов.
Вероятность закручивания молекулярных цепей и образования поворотных изомеров с повышением температуры увеличивается в связи с возрастанием при этом средней энергии тепловых ударов со стороны окружающих молекул, которые становятся соизмеримыми с величиной максимумов потенциальной кривой торможения, препятствующего их возникновению. Вместе с тем установлено, что молекулы цепного строения способны к перемещениям в объеме нефти и как жесткие системы при полном сохранении относительного расположения элементов их структуры.
Исследуя особенности движения длинноцепочных молекул углеводородов при ламинарном режиме, Штаудингер показал, что в этих условиях молекулы углеводородов ведут себя как твердые плоские ленты коллоидных размеров. Такое представление о состоянии и способе перемещений молекул углеводородов тем ближе к действительности, чем короче их цепи и ниже температура окружающей среды.
Установлено, что алифатические углеводороды способны к образованию цепных молекул большой длины. Связь между молекулами при этом осуществляется за счет дисперсионных сил Ван-дер-Ваальса между метиленовыми СH2 или концевыми метальными СНз группами соседних молекул. Длина образовавшихся макромолекул ограничивается в этих случаях лишь устойчивостью их по отношению к тепловому движению, а также величиной градиентов скорости потока. При больших скоростях потока и высокой температуре среды молекулярные нити легко разрушаются и генерируются вновь. Поскольку углеводороды цепного строения могут существовать в растворах в виде как прямолинейных, так и хаотически закрученных цепей, статическое равновесие между модификациями обоих типов определяется абсолютным значением температуры и может быть сдвинуто в ту или иную сторону.
B кристаллическом состоянии могут быть не только алифатические, но и нафтеновые и даже ароматические углеводороды. Строение молекул углеводородов двух последних типов также изучено, хотя и в несколько меньшей степени, чем алифатических. Согласно данным конформационного анализа, молекулы нафтеновых углеводородов представляют собой замкнутые метиленовые кольца с алифатическими цепями различной длины нормального и разветвленного строения. Ароматические же углеводороды имеют в своей основе плоские структуры бензольного ядра. Таким образом, молекулы основных типов высокомолекулярных соединений нефти характеризуются особой, присущей им геометрической формой. Они могут быть линейной либо разветвленной цепью или трехмерной структурой, представляющей собой цепи, соединенные поперечными связями. Причем только парафиновые углеводороды нормального строения могут иметь нитевидные молекулы меандровидной формы, а для их изомеров характерно разветвленное строение.
Сергиенко отмечает, что все остальные углеводороды практически не укладываются ни в одну из этих форм и имеют гроздевидную форму, поскольку для высокомолекулярных соединений нефти вообще характерно преобладание гибридных или смешанных структур молекул. В принципе все твердые соединения стремятся образовывать кристаллы, если существующие условия благоприятствуют этому. Однако степень способности образовывать кристаллы зависит прежде всего от строения молекул и их размера. Она может значительно уменьшиться при неблагоприятных условиях.
Род кристаллов, правильность их строения и величина также зависят от химической природы соединений. Не меньшее значение при образовании кристаллов имеют длина, форма и подвижность молекул. Очевидно, все известные парафины при определенных условиях могут образовывать кристаллы. Однако в данном случае речь идет о способности парафинов образовывать кристаллические структуры именно в нефти и при тех условиях, в которых нефть движется от забоя скважины до нефтеперерабатывающих заводов.
Появление кристаллических структур связано с упорядоченным расположением молекул в решетке кристаллов. Очевидно, это достигается тем проще, чем при всех прочих равных условиях молекулы будут иметь достаточно правильное строение и сравнительно небольшую длину. Молекулы простого строения, особенно неразветвленные цепи, как, например, нормальные алканы, способны к наиболее тесной и правильной упаковке. Однако простое строение молекул только тогда способствует более тесной упаковке, когда их подвижность в момент превращения вещества в твердое состояние остается достаточно высокой.
Цепи значительного размера вследствие уменьшения подвижности теряют способность располагаться одна за другой по всей длине. Только часть цепей в этом случае может ориентироваться параллельно, тогда как остальная часть цепей затвердевает в неупорядоченном состоянии. Таким образом, рядом образуются кристаллические и аморфные центры. Одна и та же молекула может принадлежать к нескольким таким центрам.
Молекулы с боковыми цепями имеют по сравнению с эквимолекулярными нормальными парафинами пониженную подвижность и затрудненную способность к ориентировке. Отходящие наружу боковые цепи мешают тесной упаковке молекул, особенно если их масса значительно больше массы водорода. Молекулам со многими боковыми цепями еще труднее образовывать правильно сформированные единицы, поэтому, несмотря на сравнительно высокий молекулярный вес, они могут оставаться жидкими при комнатной температуре. Поскольку способность парафинов образовывать кристаллические структуры в присутствии природных ПАВ (смолы, асфальтены) в значительной мере подавляется, очевидно, было бы правильным полагать, что образующиеся в нефти кристаллические образования имеют значительное количество аморфных зон, которые во многом определяют их необычную форму и структуру.
Известен ряд кристаллических модификаций парафинов. Как уже отмечалось, кристаллизация в той или иной форме зависит от целого ряда обстоятельств: длины цепи, степени чистоты препарата, метода кристаллизации, режима охлаждения и др. В зависимости от условий чистые нормальные парафиновые углеводороды могут образовывать при кристаллизации четыре различные формы кристаллов: гексагональную (a-форма), орторомбическую (b-форма), моноклинную (g-форма) и триклинную (s-форма).
Молекулы парафинов с нечетным числом атомов углерода в цепи имеют плоскость симметрии, перпендикулярную к оси цепи, и образуют кристаллы ромбической сингонии. Молекулы парафинов с четным числом атомов углерода в цепи имеют центр инверсии и сохраняют этот элемент симметрии в кристаллах. Согласно теории упаковки им свойственны триклинная и моноклинная сингонии.
В результате исследований установлено, что кристаллы парафина построены исключительно из молекул трансизомерной конфигурации, углеродные цепи которых располагаются параллельными рядами, образуя наслоение друг над другом, причем столбики молекул имеют почти эллипсоидальное сечение (рис. 3). Конечные метильные группы СНз двух надстраивающихся друг над другом молекул разделены расстоянием в 4 А. Элементарная ячейка содержит четыре молекулы и имеет следующие параметры: а=7,45А; b=4,97А; с=77,2А, причем длинные оси цепей молекул всегда перпендикулярны к плоскости плотнейшего слоя их упаковки.
Рис. 3. Упаковка цепей молекул нормальных парафинов в элементарной ячейке кристалла
С—атомы углерода; Н—атомы водорода
Энергия притяжения и отталкивания между CH2 и СНз-группами молекулярных цепей в кристаллах парафина определяет энергию кристаллической решетки и, следовательно, целый ряд их физических свойств. Энергия взаимодействия между метиленовыми СН2-группами смежных молекул характеризует поперечные связи между молекулами, а энергия взаимодействия между СНз-группами определяет величину адгезии и атомного механизма скольжения в граничных слоях. В целом энергия кристаллической решетки парафинов определяется величиной порядка 2,3 ккал/моль или 1,73*10-3 эрг на одну группу СН2.
В зависимости от количества атомов углерода в цепи молекулы парафина могут располагаться в кристалле прямыми или косыми слоями. Установлено, что при формировании кристаллов косыми слоями достигается более плотная упаковка молекул.
Упаковку в кристаллах со сложными пространственными очертаниями органических молекул изучали многие исследователи. Китайгородский отмечает, что все молекулы, входящие в состав кристаллов, взаимно соприкасаются, не проникая друг в друга. В целом молекулы стремятся расположиться в кристаллах таким образом, чтобы пустоты между ними занимали наименьший объем, а выступы одной молекулы входили во впадины других, касаясь при этом друг друга во многих местах и обеспечивая тем самым плотнейшую упаковку.
В результате исследований было установлено, что плотность упаковки органических молекул обычно настолько высока, что образующиеся при этом системы отвечают наиболее плотным вариантам, не поддающимся дальнейшему уплотнению. При этом важно подчеркнуть, что в основном для плотнейшей упаковки молекул в кристаллах важно не число касаний между двумя какими-нибудь молекулами, которое может сильно изменяться от случая к случаю, а число касаний между конкретной молекулой и всеми ее окружающими. При этом всегда имеется в виду, что чем выше симметрия молекулы, тем труднее выполняется требование сохранения этой симметрии в кристалле для обеспечения плотнейшей упаковки.
В общем случае молекула удерживает в кристалле высокую симметрию тогда, когда это не требует уменьшения плотности упаковки. Именно этим условиям и отвечает упаковка молекул кристаллических углеводородов нормального строения. В общем случае коэффициент упаковки определяется прежде всего формой молекулы и оказывается тем меньше, чем менее правильна форма самой молекулы.
Установлено, что коэффициент упаковки ароматических молекул колеблется в пределах от 0,6 до 0,8 и при К<0,595 образование кристаллов вообще невозможно. Следует отметить, что соединения такого типа в обычных условиях не кристаллизуются и при охлаждении образуют стекловидные аморфные тела. Это объясняется, очевидно, тем, что упаковка таких сильно разветвленных в объеме молекул в периодические образования возможна лишь с незначительной плотностью, не достаточной для создания энергетически выгодной комбинации упаковки молекул в кристалл по сравнению с аморфным состоянием.
В этой связи можно предполагать полную невозможность кристаллизации ароматических соединений с крупным ядром и длинными боковыми цепями, в связи с чем в формировании отложений парафина они могут играть особую роль.
Длинноцепочные молекулы нормальных кристаллических парафинов упаковываются, как правило, плотными слоями с координационным числом 6 и К= 0,72. Китайгородский подчеркивает, что в межмолекулярных взаимодействиях, обусловливающих возможность возникновения кристаллических образований, основную роль играют форма молекул и их локальные микрополя.
Говоря о самом механизме возникновения зародышей и месте их образования, следует иметь в виду следующие обстоятельства. Механизм процесса кристаллизации вещества в качестве предварительной стадии включает изменение структуры жидкой фазы при снижении температуры. Сущность этих процессов заключается в увеличении упорядоченности расположения молекул растворенного вещества за счет снижения энергии тепловых ударов со стороны молекул растворителя и в последующем объединении в комплексы предварительно ориентированных молекул кристаллизующегося вещества. По мере охлаждения раствора способность молекул растворителя удерживать в рассеянном и изолированном друг от друга состоянии молекулы растворенного вещества снижается, что в целом воспринимается как снижение его растворяющей способности.
При достаточно глубоком снижении температуры растворимость парафина в углеводородной среде снижается и достигает уровня равновесного насыщения. Кристаллизация при этом, однако, не начинается, так как для этого необходимо некоторое пересыщение раствора, уровень которого должен обеспечивать возможность появления достаточно крупных кристаллов парафина с размерами больше критических размеров зародышей. Все эти особенности, объясняющие физическую сущность процессов обусловливающих появление зародышей, необходимо учитывать в первую очередь при рассмотрении вопроса кристаллизации твердой фазы из чистых растворителей, лишенных различных примесей.
Большинство специалистов, изучающих строение и закономерности роста кристаллов, самопроизвольное появление зародышей в объеме жидкой фазы в реальных условиях считает практически невозможным. Ранее действительно полагали, что зародыши кристаллов могут появляться в результате одновременного случайного столкновения многих молекул. Однако последующие теоретические и экспериментальные исследования показали, что зародышами являются взвешенные в объеме жидкой фазы твердые частицы.
Было подсчитано, например, что для образования равновесной капли при конденсации водяного пара необходимо одновременное случайное столкновение не менее 50 тысяч молекул воды. Такое событие весьма маловероятно. Дальнейшее изучение вопроса о переходе вещества из одного состояния в другое позволило выяснить, что для возникновения кристаллов необходимо наличие ядра или свободной поверхности (границы раздела фаз), на которой такой переход из одной фазы в другую оказывается возможным. Так, например, ряд исследователей экспериментально показали, что растворы, очищенные путем фильтрации от посторонней механической взвеси, в течение долгого времени при значительном пересыщении лишались способности к спонтанной кристаллизации.
В настоящее время идея образования зародышей кристаллизации не за счет флуктуаций, а путем кристаллизации на поверхностях раздела фаз — на твердых частицах — получает все большее и большее распространение. Наилучшими объектами для возникновения зародыша и впоследствии роста кристаллов парафина являются: 1) более мелкие кристаллы парафина; 2) поверхности, модифицированные ПАВ, которые могут образовывать твердые растворы с кристаллическими углеводородами, например некоторые виды смолистых веществ нефти; 3) вещества, способные адсорбировать на себе молекулы твердых углеводородов; 4) вещества, имеющие одинаковое с парафинами строение и размеры структур элементарной ячейки.
Наряду с этим большое значение в возникновении зародышей имеет состояние поверхности, т. е. наличие на ней впадин, шероховатостей и т. д. На шероховатых поверхностях возникновение зародышей более вероятно, чем на гладких. Ранее уже отмечалось, что молекулы твердых углеводородов имеют цепочное строение. Поэтому при взаимодействии с поверхностью они могут занимать два основных положения, а именно: располагаться длинной осью параллельно поверхности или перпендикулярно к ней.
Так как молекулы упаковываются в кристаллах парафина плотными параллельными рядами, то первоначальное расположение молекул над поверхностью определит и ориентацию растущего кристалла.
Ряд данных позволяет считать, что неполярные углеводороды в равновесных условиях располагаются над твердой поверхностью, например металла, параллельно ей своей длинной осью (что отвечает минимуму потенциальной энергии молекул, находящихся в поле притяжения твердой фазы). Это в сущности и определяет ориентацию растущих кристаллов на твердой поверхности.
Кристаллизация парафина как на поверхности, так и в объеме нефти, начинается при появлении в растворе достаточного количества молекул углеводородов, принявших прямолинейную форму. Переход молекул в такое состояние, как уже отмечалось раньше, связан эффектом «вымораживания» длинноцепочных молекул, сопровождающимся раскручиванием расположенных в трех плоскостях меандровидных молекул углеводородов. Ввиду известной склонности таких молекул к параллельной ориентации последние могут образовывать уже в тонком пристенном слое или в объеме нефти своеобразные пакеты из определенного количества объединившихся молекул, облегчая тем самым последующие образования зародышей и возможность быстрого роста кристаллов.
Поэтому возникновение зародыша парафина и последующий рост кристаллов можно представить как ряд последовательно протекающих процессов по «вымораживанию» молекул и приданию им прямолинейной конфигурации, их предварительной ориентации друг относительно друга, фиксированию параллельно поверхности в поле действия молекулярных сил конденсированной фазы и последующему наслаиванию молекул и их пластов таким образом, что входящие в состав зародыша или кристалла молекулы соприкасаются друг с другом силовыми полями атомов водорода, расположенных вдоль длинной оси молекул.
Поскольку процесс возникновения зародыша кристалла во многом определяет его ориентацию, следует отметить, что при отсутствии стерических препятствий к росту зародышей от подложки в сторону жидкой фазы кристаллы парафина ориентируются таким образом, что они сочленяются с поверхностью одной из своих остроугольных граней (рис. 4). Другими словами, говоря об особенностях накопления парафина на поверхностях, можно еще раз отметить, что различие между процессами кристаллизации на твердой поверхности и в объеме жидкой фазы заключается в наличии в первом случае условий принудительного роста кристаллов в заданном твердой поверхностью направлении.
При добавлении ПАВ структура кристаллов резко изменяется. Возникающие при этом кристаллические образования не имеют ничего общего с правильными ограненными кристаллами, которые образуются при кристаллизации из углеводородной среды, не содержащей этих веществ. Причем влияние ПАВ проявляется не в диспергирующем эффекте, как это утверждают многие авторы, а в глубоких изменениях формы и структуры самих кристаллов.
Говоря о диспергирующем действии ПАВ, было бы неверно подразумевать при этом проявление эффекта, эквивалентного только механическому дроблению. Исследованиями показано, что процессы, происходящие при адсорбции асфальтово-смолистых веществ на поверхности кристалла, приводят к возникновению дендритных структур большого объема и низкой плотности, свободные полости которых заполнены нефтью.
Утверждение о диспергирующем действии ПАВ в целом справедливо для начальной стадии роста кристаллов, так как впоследствии все в большей степени проявляется эффект растворения мелких кристаллических образований и перегонка строительного материала к более крупным. Поэтому в конечном итоге кристаллические друзы оказываются еще больше, чем при росте кристаллов в нормальных условиях.
Дендритные структуры могут образовываться по следующей схеме. Вследствие угнетающего действия смолистых веществ на возникновение и рост кристаллов правильной формы процесс кристаллизации может идти в избирательных направлениях с участков кристаллов, блокированных асфальтово-смолистыми веществами в меньшей степени. В этих местах начинается быстрое нарастание кристаллизующегося вещества по схеме монокристаллических образований до тех пор, пока в данном микроучастке нефти не снизится его перенасыщенность, а поверхность кристаллического новообразования не окажется вновь блокированной смолистыми веществами. При этом рост части кристалла приостанавливается, а от его вершин и ребер в сторону наиболее высокой концентрации кристаллизующегося вещества начинают расти новые участки кристаллов.
В зависимости от условий кристаллизации могут возникать различные модификации кристаллических структур: дендритная, сферолитная и смешанная— дендритно-сферолитная.

Рис. 4. Рост кристаллов парафина на поверхности металла (увеличение в 60 раз). Кристаллы закреплены на поверхности одной из своих остроугольных граней.
Поможем написать любую работу на аналогичную тему

