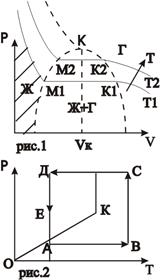
 Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка: Ж,Ж+Г,Г. Штриховая линия М1М2К-кривая точек кипения этана. К1К2К- кривая точек конденсации (или точек росы). В точке К пунктирной линии кривые кипения(парообразования) и конденсации сливаются. Эта точка называется критической. При увеличении Р метан будет в газовом состоянии. С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать. Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Давление, при котором газ начинает конденсироваться называется давлением насыщения для газа.
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка: Ж,Ж+Г,Г. Штриховая линия М1М2К-кривая точек кипения этана. К1К2К- кривая точек конденсации (или точек росы). В точке К пунктирной линии кривые кипения(парообразования) и конденсации сливаются. Эта точка называется критической. При увеличении Р метан будет в газовом состоянии. С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать. Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Давление, при котором газ начинает конденсироваться называется давлением насыщения для газа.
Фазовые превращения углеводородов можно также представить в координатах давление-температура рис.2. ОК – характеризует 2-х фазное состояние (Ж+Г). Из рис.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки С, расположенную выше критической точки К, и далее в область точки Д. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки С до точки Д), а затем при снижении давления до точки Е вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
Поможем написать любую работу на аналогичную тему

