Вода, используемая на технологические нужды промпредприятий, несколько отличается по своим качествам от воды питьевой. Как правило, вода, идущая на производственные нужды, не должна содержать газов, таких, как углекислота, кислород, сероводород, аммиак; должна быть мягкой, с низким солесодержанием. Поэтому перед использованием воды на технологические нужды в зависимости от требований технологического процесса она подвергается соответствующему кондиционированию.
Наиболее распространенная технологическая операция — умягчение воды. Под умягчением воды понимают процесс удаления из нее катионов жесткости, т.е. кальция и магния.
Если для питьевой воды предельно допустимая жесткость составляет 7 мгэквл и, как правило, вода для питьевых целей не умягчается, то при подготовке технологической воды требуется очень глубокое умягчение. Для воды, идущей на получение пара в паровых котлах, допустимая жесткость воды — не более 0,005 мгэкв/л.
Умягчение воды осуществляется следующими методами: термическим, реагентным, ионного обмена, диализа, мембранным.
Термический метод умягчения применяется при использовании вод с карбонатной жесткостью для питания котлов низкого давления, а также в теплообменных аппаратах. При нагревании воды бикарбонаты кальция и магния распадаются с образованием карбонатов этих элементов, выпадающих в осадок:
Так как карбонаты кальция и магния хотя и незначительно, но растворяются в воде, полностью удалить карбонатную жесткость термическим способом невозможно.
Умягчение воды реагентным способом основано на обработке ее реагентами, образующими с Са и Mg водорастворимые соединения, СаСО3, MgCO3, Mg(OH)2, Ca3(PO4)2, Mg3(PO4)2 с последующим их отделением в отстойниках, осветлителях и на фильтрах. В качестве реагентов используют известь, соду, гидроксиды.
Схема водоумягчительной установки, работающей по реагентному способу, представлена на рис. 5.
В качестве контактной массы можно использовать песок, керамзит или мраморную крошку крупностью зерен 0,2-0,3 мм.
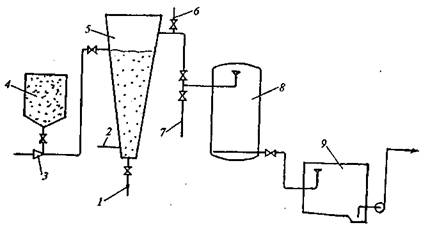
Рис. 5. Схема реагентного метода умягчения: 1 — выпуск отработавшей контактной массы; 2 — подача воды на умягчение; 3 — эжектор; 4 — бункер с контактной массой, 5 — реактор; 6 — подача реагентов; 7 — сброс промывной воды; 8 — скорый фильтр; 9 — резервуар умягченной воды.
В вихревом реакторе поток воды закручивается и поднимается вверх. В восходящем вихревом движении частички контактной массы взвешиваются. На поверхности частичек кристаллизуется CaCO3 и MgCO3. Песчинки растут и превращаются в шарики диаметром до 1,0-2,0 мм. Крупные шарики опускаются вниз и периодически выпускаются через патрубок 7.
Вихревые реакторы не задерживают Mg(OH)2. Поэтому для извлечения Mg(OH)2 после реакторов устанавливают фильтры.
Сущность умягчения воды ионным обменом заключается в способности некоторых ионообменных материалов, называемых ионитами, поглощать из воды положительные или отрицательные ионы в обмен на эквивалентное количество ионов пинита.
Процесс водообработки методом ионного обмена, в результате которого происходит обмен катионов, называется катионированием. Каждый катионит обладает определенной обменной емкостью. Обменную емкость катионита измеряют в грамм-эквивалентах задержанных катионов на 1 м3 катионита. При этом имеется в виду рабочая обменная емкость, т.е. то количество катионов кальция и магния, которое задерживается 1 м3 катионита до момента нормативного «проскока» в фильтрат катионов жесткости.
При обессоливании воды на промпредприятиях наиболее часто используются дистилляция, ионный обмен и обратный осмос. Выбор метода обессоливания обусловливается качеством исходной воды, требованиями, предъявляемыми к качеству очищенной воды, производительностью установки.
Промышленный опыт показывает, что при содержании солей в воде до 3 г/л следует рекомендовать ионообменный метод, более 10 г/л — дистилляцию, замораживание или обратный осмос, при концентрации солей в воде от 3 до 10 г/л предпочтителен обратный осмос.
Воду, содержащую кремниевую кислоту, нельзя использовать для питания котлов высокого давления, в химико-фармацевтической промышленности, при производстве текстиля. Формы присутствия в воде кремниевой кислоты варьируются от коллоидной до дисперсной. При использовании в теплосиловых установках воды, содержащей кремнекислоту и соли жесткости, образуются сложные силикатные накипи с катионами кальция, магния, железа. Силикатная накипь обладает низким коэффициентом теплопроводности и существенно снижает теплотехнические показатели работы котлов и ионообменных аппаратов.
Обескремнивание воды достигается осаждением известью, сорбцией гидроксидами алюминия, железа, оксидом или гидроксидом магния, фильтрованием через магнезиальный сорбент, ионным обменом.
Обескремнивание воды известью основано на небольшой растворимости силиката кальция; при наличии в исходной воде до 10-12 мг/л SiO32 - остаточное содержание ее в обработанной воде составляет 6-8 мг/л. При избытке извести и подогреве воды глубина обескремнивания возрастает.
Обескремнивание воды солями железа основано на способности хлопьев Fe(OH)3, образующегося при введении в воду его солей, сорбировать молекулярно-дисперсную и коллоидную кремниевую кислоту.
Установка, используемая для обескремнивания воды солями железа, состоит из смесителя, дозаторов реагента и известкового молока, осветлителя, фильтра и насоса для рециркуляции осадка. Благодаря рециркуляции значительно снижается расход коагулянта.
Тот же механизм при обескремнивании сульфатом алюминия.
Магнезиальный метод обескремнивания воды основан на способности соединений магния (оксида магния, обожженного доломита, каустического магнезита) сорбировать из водных растворов коллоидную и молекулярно-дисперсную кремниевую кислоту, причем остаточное содержание SiO2 в очищенной воде не превышает 1-1,5 мг/л.
Поможем написать любую работу на аналогичную тему

