Рассмотрим термодинамические системы, в которых не производится полезная работа (![]() = 0). Тогда из уравнений (3.5) имеем:
= 0). Тогда из уравнений (3.5) имеем:
![]() ,
, ![]() ,
,
![]() ,
, ![]() (направление процесса).
(направление процесса).
В состоянии равновесия:
![]() ,
, ![]() ,
, ![]() ,
, ![]() . (3.6)
. (3.6)
Наиболее часто, чтобы определить направление процесса в закрытых системах, используют энергию Гиббса (при T = const, P = const) .
Рассмотрим систему с одной химической реакцией. Изменения количеств веществ будем описывать с помощью одной химической переменной ![]() . Начальные количества реагентов (ni0) будут при этом параметрами. Тогда
. Начальные количества реагентов (ni0) будут при этом параметрами. Тогда
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
,
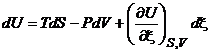 ,
, 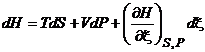 ,
,
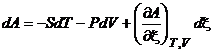 ,
, 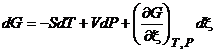 . (3.7)
. (3.7)
Из уравнений (3.7) следует, что если процесс проводится при постоянных значениях стандартных переменных, то
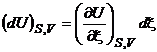 ,
, 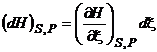 ,
,
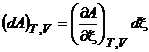 ,
, 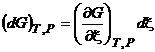 . (3.8)
. (3.8)
Таким образом,
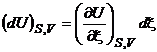 =
= 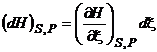 =
= 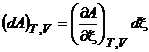 = =
= = 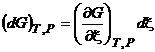 =
= ![]() (
(![]() - хим. потенциал) (3.9)
- хим. потенциал) (3.9)
Химическое сродство реакции Ar:
![]() (характеризует степень отклонения от равновесия) (3.10)
(характеризует степень отклонения от равновесия) (3.10)
в равновесии
![]() (условие равновесия) (3.11)
(условие равновесия) (3.11)
Парциальная мольная величина:
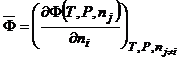 (3.12)
(3.12)
где ![]() - любая экстенсивная (аддитивная) функция. Например, энергия Гиббса:
- любая экстенсивная (аддитивная) функция. Например, энергия Гиббса:
![]() (3.13)
(3.13)
Только для энергии Гиббса парциальная мольная величина совпадает с химическим потенциалом:
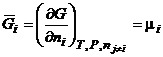 (3.14)
(3.14)
![]() (3.15)
(3.15)
Поможем написать любую работу на аналогичную тему

