В растворах электролитов невозможно изменять концентрацию только катионов, не меняя при этом концентрацию анионов. Поэтому экспериментальные данные позволяют определить только среднеионный коэффициент активности.
Рассмотрим электролит типа MmLl , диссоциирующий на ионы по уравнению
![]() (9.22)
(9.22)
Энергия Гиббса исходной соли, растворенной в числе n молей и имеющую концентрацию C :
![]() (9.23)
(9.23)
Энергию Гиббса этой же соли в растворе можно записать через химические потенциалы отдельных ионов:
![]() (9.24)
(9.24)
Это же выражение можно записать через среднеионный коэффициент активности ![]() :
:
![]() (9.25)
(9.25)
Сравнивая (9.23) и (9.25), получаем выражение для активности соли
![]() (9.26)
(9.26)
где среднеионный коэффициент активности
![]() (9.27)
(9.27)
Используя выражение для коэффициентов активности ионов из теории Дебая-Хюккеля, можно получить уравнение Дебая-Хюккеля для среднеионного коэффициента активности:
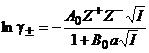 (9.28)
(9.28)
Если член ![]() мал по сравнению с единицей, то получаем предельное уравнение Дебая-Хюккеля:
мал по сравнению с единицей, то получаем предельное уравнение Дебая-Хюккеля:
![]() (9.29)
(9.29)
Поможем написать любую работу на аналогичную тему

