Рассмотрим водородный электрод
![]()
При этом металлическая платина заряжается отрицательно, а раствор – положительно. H+ , покидая платину, совершает работу против электрических сил. В равновесии
![]() (10.1)
(10.1)
где ![]() - химический потенциал электрона в платине. Раскрывая это выражение, получим
- химический потенциал электрона в платине. Раскрывая это выражение, получим
![]()
где ![]() и
и ![]() - электрический потенциал раствора и платинового электрода, соответственно;
- электрический потенциал раствора и платинового электрода, соответственно; ![]() - летучесть газообразного водорода;
- летучесть газообразного водорода; ![]() - активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в реакции; F – число Фарадея (F = eNa = 96485 Кл/моль). Для разности потенциалов находим
- активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в реакции; F – число Фарадея (F = eNa = 96485 Кл/моль). Для разности потенциалов находим
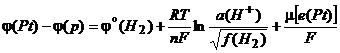 (10.2)
(10.2)
где
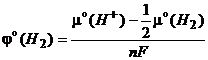 (10.3)
(10.3)
представляет собой стандартный электродный потенциал водородного электрода, принимаемый равным нулю для указанных выше стандартных условий. Величину
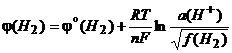 (10.4)
(10.4)
называют потенциалом полуэлемента, или электродным потенциалом. Эту величину записывают в общем виде
![]() (10.5)
(10.5)
Поможем написать любую работу на аналогичную тему

