Важнейшим типовым понятием является недостаточность кровообращения - неспособность системы кровообращения обеспечить потребность органов и тканей O2 и субстратами метаболизма.
Понятие патофизиологии кровообращения включает в себя понятия сердечной и сосудистой недостаточности.
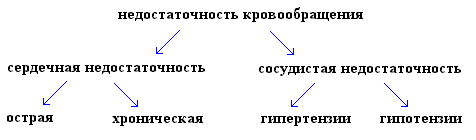
I. Сердечная недостаточность (СН) (insufficientia cordis) – патологическое состояние, обусловленное неспособностью сердца обеспечить адекватное кровоснабжение органов и тканей кровью ,т.е.неспособностью перекачать всю поступающую венозную кровь (в отличии от сосудистой недостаточности - недостаток притока к сердцу венозной крови).
Классификация сердечной недостаточности с учетом этиологического фактора:
1) миокардиально-обменная форма сердечной недостаточности при повреждении сердца токсическими продуктами, инфекционными и аллергическими факторами.
2) недостаточность сердечной деятельности от перегрузки, переутомления и развивающихся вторичных изменений.
3) смешанная - при сочетании факторов повреждения и перегрузки.
Сердечная недостаточность может быть острая и хроническая по остроте течения, лево-и правожелудочковая. При левожелудочковой сердечной недостаточности застой в малом круге кровообращения, а при правожелудочковой - в большом.
Показатели сердечной недостаточности:
а) либо нарушение гемодинамики;
б) либо нарушение ритмической деятельности сердца,
в) либо то и другое.
Показатели нарушения гемодинамики:
1) понижение МОС (особенно при острой СН);
2) понижение АД=МО·периферическое сопротивление (ПС);
3) уменьшение линейной или объемной скорости кровотока;
4) изменение ОЦК (при острой СН чаще уменьшение, при хронической - чаще увеличение); 5) специфично для сердечной недостаточности - повышение центрального везнозного давления (или системного при правожелудочковой недостаточности. При инфаркте миокарда падает МО, а АД может даже повышаться за счет ЧСС.
II. Нарушение ритмической деятельности сердца (регистрация ЭКГ позволяет выявить нарушение частоты, периодичности, цикличности и силы сердечных сокращений). Прежде всего вспомним проводящую систему сердца: комплекс анатомических образований (узлов, пучков и волокон, обладающих способностью генерировать импульс сердечных сокращений и проводить его ко всем отделам миокарда предсердий и желудочков, обеспечивая их координорованные сокращения. В этой системе выделяют две взаимосвязанные части: синусно-предсердную и атрио-вентрикулярную. К синусно-предсердной относятся синусно – предсердный узел с отходящими от него пучками сердечных проводящих миоцитов. Атрио-вентрикулярная часть представлена атрио-вентрикулярным узлом, пучком Гисса с его левой и правой ножками и переферическими разветвлениями – проводящими волокнами Пуркинье.
Формы и механизмы аритмии:
Аритмии - (отсутствие ритма, неритмичность) - различные изменения основных электрофизиологических характеристик миокарда (автоматизма), ведущие к нарушению нормальной координации сокращений различных участков миокарда или отделов сердца с резким учащением или урежением сердечных сокращений.
1. Аритмии, связанные с нарушением ритма сердечных сокращений.
а) синусовая тахикардия;
б) синусовая брадикардия;
в) синусовая аритмия;
г) атрио-вентрикулярная аритмия.
Синусовая тахикардия - увеличение частоты сердечных сокращений более 90 минут у взрослых.
Различают физиологическую и патологическую тахикардию.Под физиологической тахикардией понимают увеличение ЧСС под влиянием различных воздействий при отсутствии патологических изменений сердечно-сосудистой системы: при физической нагрузке, эмоциональном напряжении, изменении окружающей среды, и т.п. за счет повышения тонуса симпатической нервной системы как реакция защиты, форма приспособления.
Причиной патологической тахикардии может быть экстракардиальные заболевания и различные поражения сердечно-сосудистой системы и др. заболевания организма: при интоксикациях, пороках сердца, инфаркте миокарда, ревматизме.
Синусовая брадикардия (ваготония - меньше 60): у здоровых лиц либо в следствие врожденного понижения автоматизма синусно-предсердного узла, либо у спортсменов как результат изменений энергетического режима организма и режима гемодинамики. Патологическа синусовая брадикардия часто бывает следствием раздражения системы блуждающего нерва (nervus vagus) при травмах ЦНС, патологических процессах в средостении, раздражении блуждающего нерва при язвенной и желчно-каменной болезни, при действии ряда лекарственных препаратов, при патологических процессах в миокарде.
Синусовая аритмия: непостоянство ритма сердечных сокращений, связанное с колебаниями активности синусового узла.В физиологических условиях может быть у молодых людей и связана с актом дыхания - повышение тонуса nervus vagus. При патологии может быть чередование тахи- и брадикардии - неблагоприятный показатель при тяжелом состоянии сердца - показатель истощения сердца.
Атрио-вентрикулярная аритмия - при слабости синусового узла вследствие тяжелых поражений миокарда функцию узла - производителя ритма берет атрио-вентрикулярный узел (редкий ритм 30-40 мин, но с синхронизацией сокращения отделов сердца - хотя желудочки сокращаются раньше предсердий). При поражении атрио-вентрикулярного узла импульсы возникают в ножках и пучке Гиса и идут ретроградно по мышечным волокнам с частотой 10-30 и после отдыха синусовый узел может брать на себя функцию водителя ритма.
2. Аритмии, связанные с патологическим повышением возбудимости миокарда:
а) экстрасистолии;
б) пароксизмальная тахикардия;
в) мерцание предсердий и желудочков. Иногда может быть внесердечного происхождения.
Экстрасистолия - нарушение ритма сердца с возникновением одиночных или парных преждевременных сокращений сердца (экстрасистол), вызываемых возбуждением миокарда не из физиологического источника сердечного ритма. В зависимости от места расположения очага эктопической активности экстрасистолы делят на предсердные, атрио-вентрикулярные и желудочковые. Очень редко возникает синусовая экстрасистолия. Экстрасистолия может быть при всех болезнях сердца, интоксикациях, отравлениях, гипертиреозе, аллергии, гипертензии в малом круге кровообращения. Одиночные экстрасистолии переносятся легко, но залповые (больше 5 мин) - вызывают расстройства кровообращения.
Пароксизмальная тахикардия - приступообразное учащение ЧСС, обусловленное патологической циркуляцией экстрасистолического возбуждения или патологически высокой активностью очага гетеротопного автоматизма в сердце. Сердечные сокращения при пароксизмальной тахикардии строго ритмичны, ЧСС от 120 до 220/мин, у детей может быть до 260. Продолжительность приступа от нескольких секунд до нескольких дней, иногда недель, причем ЧСС не меняется. По месту расположения эктопического очага автоматизма выделяют также 3 формы: предсердную, антриовентрикулярную и желудочковую. Первые две формы еще называют наджелудочковой пароксизмальной тахикардии. Причины наджелудочковой пароксизмальной тахикардии - ревматические пороки сердца, кардиосклероз, ишемическая болезнь сердца (ИБС), тиреотоксикоз и гипертоническая болезнь. Желудочковая пароксизмальная тахикардия возникает чаще при тяжелом поражении сердца у больных с ИБС, миокардитам, при передозировке сердечных гликозидов. При любой форме пароксизмальной тахикардии возникновению приступа может способствовать эмоциональное или физическое напряжение, глубокое дыхание с гипервентиляцией, резкое изменение положение тела, переедание. В основе лежит нарушение мембранных процессов с повышенной возбудимостью миокардиоцитов. Страдает гемодинамика - не заполняются камеры сердца.
Самая тяжелая форма - мерцание предсердий и желудочков - беспорядочные несинхронизированные сокращения миокардиоцитов до 800/мин - сердце не способно перекачивать кровь - падает АД - потеря сознания. Предсердная мерцательная аритмия - нет ни систолы, ни диастолы, жизнь за счет сокращения желудочков, но если и в них мерцание - смерть.
III. Нарушение проводимости - блокада сердца - замедление или полное прекращение распространения по проводящей системе сердца импульса возбуждения. Различают:
а) сино-аурикулярную,
б) внутрипредсердную,
в) предсердо-желудочковую и
г) внутрижелудочковую блокады.
Если происходит прекращение проведение импульса на каком то уровне - наступает полная блокада. При частичной (неполной) блокаде отмечается замедление проведение импульса возбуждения. По течению блокады сердца бывают постоянными, временными и интермиттирующими (более подробно - несколько позднее).
IV. Нарушение сократимости миокарда.
V. Нарушение ферментативного спектра миокарда.
Острая сердечная недостаточность (ОСН) - ее виды, причины, и патогенез, некоторые принципы диагностики и патогенетической терапии.
Жизнь - или смерть - если не успеть помочь, а для этого нужно разобраться и принять необходимые лечебные меры.
Пять форм ОСН:
а) тампонада сердца,
б) полная атрио-вентрикулярная блокада,
в) мерцание, фибрилляция желудочков,
г) инфаркт миокарда и
д) острая закупорка легочной артерии.
Тампонада сердца - синдром острой сердечной недостаточности, вызванной внутриперикардиальным сдавлением сердца жидкостью (гемотампонада, перикардит острый экссудативный) или газом.
Патогенез нарушений:
1) механическое сдавление тонкостенных отделов сердца и крупных вен → уменьшение наполнения его полостей. Развивается синдром низкого сердечного выброса (резкое уменьшение сердечного и МОС), уменьшение тканевого кровотока, олигоурия, повышение потребления, повышение потребления O2 и увеличение содержания в крови молочной и пировиноградной кислоты и
2) патологический вагусный рефлекс - из-за растяжения перикарда → раздражение nervus vagus → может быть остановка сердца, АД понижается, а венозное повышается. При наличии большого выпота, когда резко ограничивается диастола и сильное затруднена работа сердца - возниает кислородное голодание мозга: беспокойство, чувство тревоги. Нарастает бледность кожи и затем цианоз. Это легко воспроизводится в эксперименте.
Диагностика - клинически - резкий застой крови в венах лица, шеи.
Терапия - максимально быстро освободить полость прикарда от жидкости или газа методом пункции.
Полная атрио-вентрикулярная блокада - различают 4 степени атрио-вентрикулярной блокады:
1 степень - удлинение времени предсердно-желудочкового проведения;
2 степень - выпадение некоторых желудочковых комплексов после постепенного удлинения интервала P-Q, но после выпадения желудочкового сокращения проводимость на непродолжительное время улучшается, а затем вновь периоды Венкебаха - Самойлова.
При блокаде 3 степени из предсердий в желудочки проводится лишь каждый 2, 3, 4-й импульс и
4 стадия - полная поперечная блокада.
Причины: гипоксия, тяжелая патология миокарда с нарушением метаболизма, инфаркт миокарда, интоксикация, рубцы, ревматизм. Нет синхронизации сокращений предсердий (60-70/мин) и желудочков (40-50). Если обе систолы вместе - холостое сокращение желудочков и снижение МО. Нарушение предсердно-желудочковой проводимости - частая причина нарушения сердечного ритма, уступающая по частоте лишь экстрасистолии, мерцательной аритмии и пароксизмальной желудочковой тахикардии.
Диагностика - ЭКГ.
Патогенетическая терапия - вживление кардиостимулятора - водителя ритма (только для желудочков или всего сердца) либо со стабильным ритмом 60-70, либо один - регистрирующий электрод в области синусно-предсердного узла, а второй - стимулирующий - в обл атриовентрикулярного узла - воспроизводит ритм и будет полная синхронизация сердечных сокращений (с кардиостимулятором живет и работает академик Амосов).
Мерцание желудочков - форма мерцательной аритмии - нарушение ритма сердца с частыми и нерегулярными возбуждениям миокарда и полной разнородностью сердечных сокращений по частоте, силе, причем длительность сердечных циклов значительно колеблется и носит случайный характер. При мерцании частота волн на ЭКГ более 6300/ мин (обычно 500-800/ мин), а при трепетании - менее 300/мин. Глянцевая поверхность миокарда при этом мерцает, напоминая рябь на поверхности воды, в связи с чем это состояние получило название "мерцание" предсердий.
Фибрилляция - наличие сокращений миокардиальных волокон при отсутсвии сокращения всего миокарда как целого. Сердечные волокна сокращаются разрозненно и разновременно не выполняя насосную функцию: УО и МО = 0, гибель через 5 мин, человек не может жить.
Причины: тяжелая гипоксия, ишемия миокарда, интоксикация, нарушение электролитного баланса, повреждение механическое и электротоком, низкая темпиратура, нервно-психическое возбуждение, применение симпатомемитических средств при наркозе.
Наиболее распространенные теории:
1) наличие множества гетеротропных очагов, из-за которых мышечные волокна сокращаются изолированно, а не все вместе, и
2) теория циркуляции волны возбуждения на основе механизма повторного входа из-за множественныых локальных нарушений проводимости в миокарде и проводящей системе сердца. При этом ритм сокращения пораженных волокон отличается от других волокон и создаются условия для фибрилляции желудочков.
Диагностика - ЭКГ - нет цикла.
Патогенетическая терапия - дефибрилляция:
1) приведение всех миокардиоцитов одномоментно в одно состояние абсолютной рефрактерности, применяя одиночный короткий 0,01 сек мощный разряд электрического тока (при прямой дефибрилляции 10-12 А, при наружной - до 30 А) и
2) затем ритмическая стимуляция сокращений сердца электрическим током малой силы как в кардиостимуляторе.
Однако есть определенная опасность - при дефибрилляции гибнут миокардиоциты.
Инфаркт миокарда (ИМ) (infarctus myocardii) - острое заболевание, обусловленное развитием одного или нескольких очагов некроза в серд. мышце, проявляющиийся различными нарушениями сердечной деятельности и клиническими синдромами, связанными с развитием острой ишемии и некроза миокарда. Некроз может быть и не сосудистого происхождения - электролитно-стероидный. Различают крупноочаговый и мелкоочаговый ИМ с указанием зоны поражения (перегородка, стенка...). В зависимости от распространения некроза по толщине стенки выделяют:
а) трансмуральный (поражение распространяется на всю толщину миокарда и прилежащие эндокард и перикард),
б) интрамуральный - некроз развивается внутристеночно,
в) субэпикардиальный - некроз в слое миокарда, прилежащем к висцеральному листку перикарда и
г) субэндокардиальный - у эндокарда.
Наиболее частой причиной ИМ является прекращение притока крови к участку миокарда в измененных атеросклерозом коронарных артериях. Эмболия коронарных артерий встречается крайне редко. Чаще всего ИМ развивается при ишемической болезни сердца (ИБС). Огромное влияние имеют функциональные расстройства коронарного кровообращения, рефлекторный спазм коронарных артерий. К факторам риска относят пожилой возраст, увеличение содержания липидов в сыворотке крови, артериальную гипертензию, генетическую предрасположенность, сахарный диабет, ожирение, подагру, гиподинамию, повышенную эмоциональность, курение.
Большое значение в развитии ИМ придают нарушениям микроциркуляции, гиперкоагуляция и гиперагрегация, повышение адгезивных свойств тромбоцитов. Резкое сужение просвета коронарных артерий (например, атеросклеротической бляшкой) может создать условия для возникновения острой коронарной недостаточности.
В формировании клинических проявлений ИМ участвует ряд патогенетических факторов:
1) Перераздражение интерорецепторов миокарда, эндокарда и висцерального листка перикарда с иррадицией раздражения в спинной мозг, подкорковые структуры и кору головного мозга, что формирует стрессовую реакцию. Это активирует систему гипоталамус - гипофиз - кора надпочечников с повышением в крови катехоламинов - первая фаза стресса. С ней связаны артериальная гипертензия и тахикардия, гипергликемия, эозинопения. Однако чрезвычайно интенсивная боль может вызвать развитие артериальной гипотензии и быть причиной коллапса (collapsus).
2) Острое уменьшение УО вследствие прекращения сократительной деятельности некротизирующегося учаска миокарда является одной из причин развития как преходящей артериальной гипотензии, так и необратимого кардиогенного шока, сердечной астмы, отека легких, поражения внутренних органов. Снижение МО как реакция системы кровообращения, на его поддержание развивается спазм периферических сосудов, повышение АД = централизация кровообращения (мозг, сердце за счет остальных органов).
3) Развитие резорбционно-некротического синдрома и асептического воспаления в связи с высвобождением из некротизированных клеток ферментов и токсических продуктов → увеличение количества тромбоцитов, нейтрофильный лейкоцитоз, увеличение СОЭ.
4) Перераспределение электролитов в области, прилежащей к очагу некроза ведет к возникновению электрической нестабильности миокарда в периинфарктной зоне и создает предпосылки к развитию нарушений ритма: желудочковые экстрасистолии и тахикардии. На ЭКГ - монофазная кривая. В дальнейшем формируется соединительно-тканный рубец, кардиосклероз, истончение стенки сердца и формирование аневризмы.
Диагностика: ЭКГ и лабораторное определение ферментов поврежденных клеток.
Патогенетическая терапия: поддержание сократительной функции –
а) стимуляторы деятельности сердца;
б) разгрузка его – снижение ОЦК - мочегонные средства, жгуты на конечности;
в) снять болевой синдром;
д) борьба с тромбозом - гепарин, фибринолизин - только в ранние сроки.
До 5-6 часов может быть реинфузионный синдром - продукты распада тканей вызывают вторичное нарушение миокарда и системы кровообращения.
Для снижения опасности ИМ - тренировка в состоянии гипоксииумеренное стрессирование. Тренированное сердце дает в 3 раза меньше зону некроза - клетки более устойчиы. Японцы считают, что 5 мин движения с пульсом 100/мин - достаточно для профилактики, или бег по 15 мин несколько раз в неделю.
Острая закупорка легочной артерии - тромбоз и эмболия. Патогенез - первые отделы сердца моментально переполняются кровью - острейшая смерть - рефлекс Китаева. Пример тромбоэмболии легочной артерии.
Хроническая сердечная недостаточность (ХСН) часто развивается при недостаточности кровообращения, сопровождается стенокардией в двух формах:
1) повышение уровня метаболизма миокарда при неспособности его обеспечить при физических или эмоциональных нагрузках - стенокардия напряжения;
2) при нормальной метаболической активности миокарда сужен просвет коронарных артерий - стенокардия покоя.
ХСН имеет 3 стадии:
1) Начальная, скрытая, проявляется только при физической нагрузке, а в покое гемодинамика и функции органов не нарушены.
2) Выраженная, длительная недостаточность кровообращения с застойными явлениями в малом и большом круге кровообращения, с нарушениями функций органов и обмена веществ в покое.
Период А - незначительные расстройства гемодинамики и нарушения функции сердца или только какого-либо его отдела.
Период Б - конец длительной стадии с глубокими нарушениями гемодинамики.
3) Терминальная, дистрофическая стадия недостаточности кровообращения с тяжелыми, стойкими нарушениями метаболизма и функции всех органов и необратимыми изменениями внутренних органов.
Причины:
1. хроническая коронарная недостаточность → коронаросклероз, ИБС;
2. пороки сердца - врожденные и приобретенные нарушения клапанного аппарата сердца: недостаточность → ретроградный возврат и переполнение камер сердца, стеноз → препятствие кровотоку → увеличение периферического сопротивления;
3. патологические процессы в миокарде - миокардиты, миокардиодистрофии;
4. экстракардиальные причины:
а) гипертоническая болезнь,
б) увеличение ОЦК,
в) болезни легких → затруднение кровотока в правом отделе сердца,
г) гипертиреоз - все это истощает энергитику сердца.
Клинические проявления ХСН: Одышка - наиболее ранний и частый симптом. Одышка возникает из-за накопления в крови молочной и других кислот, изменения pH, снижение ЖЕЛ. Для выраженной одышки характерны ночные приступы удушья, которые могут перейти в отек легких.
Отеки - один из характерных признаков СН - вначале скрытые, сначала на ногах, пояснице, затем по всей подкожной клетчатке. Постепенно увеличивается печень в связи с застойными явлениями при правожелудочковой недостаточности. Набухают и пульсируют шейные вены. Увеличивается селезенка. Страдают функции почек, ЖКТ.
На гипоксию реагируют различные системы, но ведущая роль принадлежит сердцу.
Формы приспособления сердца при ХСН: гиперфункция и гипертрофия.
Гиперфункция - увеличение функции без увеличения массы:
а) сначала тахикардия;
б) гетерометрическая форма гиперфункции - сердце переполнено избыточным объемом крови при недостаточности клапанного аппарата, увеличение ОЦК, увеличение диастолического наполнения и увеличение УО за счет большего растяжения миокардиоцитов. Сердце перегружено незначительно, почти в норме,
в) при стенозах, при препятствиях к выбросу крови увеличивается периферическое сопротивление - диастолическое наполенние камер не меняется, но сила сокращения увеличивается - изометрическая форма. Очень быстро изнашивается миокард, очень опасно.
Самая существенная форма приспособления - гипертрофия: полноценный тип мощной долговременной формы приспособления (сердце может увеличиваться до 3 раз). Стадии развития гипертрофии:
а) неустойчивой гипертрофии - аварийная - в сердце увеличена мышечная масса, но нагрузка на миокардиоциты больше нормы → истощение энергетических и пластических ресурсов;
б) устойчивая - компенсаторная гипертрофия - масса возрастает до восстановления нормальной нагрузки на мышечное волокно, восстанавливаются энергетические ресурсы, работа как в норме;
в) но затем истощение - т.к. при нарастании массы миокарда нет параллельного роста сосудов и нервного аппарата - развивается недостаточность сосудистой и нервной регуляции.
Поможем написать любую работу на аналогичную тему

