IIIначало ТЕРМОДИНАМИКИ: по мере приближения температуры к абсолютному нулю энтропия всякой равновесной системы при изотермических процессах перестает зависеть от каких-либо термодинамических параметров состояния и в пределе ![]() принимает одну и туже для всех систем постоянную величину, которую можно положить равной нулю.
принимает одну и туже для всех систем постоянную величину, которую можно положить равной нулю.
![]() или
или 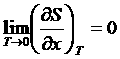 ,где
,где ![]() - любой термодинамический параметр.
- любой термодинамический параметр.
Постоянство энтропии ![]() при
при ![]() согласно III начала ТЕРМОДИНАМИКИ означает что изотермический процесс является одновременно и изоэнтропическим, а следовательно, и адиабатическим. Таким образом, по третьему началу ТЕРМОДИНАМИКИ нулевая изотерма совпадает с нулевой адиабатой.
согласно III начала ТЕРМОДИНАМИКИ означает что изотермический процесс является одновременно и изоэнтропическим, а следовательно, и адиабатическим. Таким образом, по третьему началу ТЕРМОДИНАМИКИ нулевая изотерма совпадает с нулевой адиабатой.
Некоторые следствия III начала ТЕРМОДИНАМИКИ:
1) Недостижимость абсолютного нуля температуры.
Из третьего начала ТЕРМОДИНАМИКИ непосредственно следует недостижимость абсолютного нуля температуры. Действительно, нулевая изотерма ![]() совпадает с нулевой изоэнтропой
совпадает с нулевой изоэнтропой ![]() , т.е. с граничным членом семейства
, т.е. с граничным членом семейства ![]() . Но охлаждение осуществляется в результате адиабатического процесса, когда система производит работу за счет убыли своей внутренней энергии. Так как адиабаты
. Но охлаждение осуществляется в результате адиабатического процесса, когда система производит работу за счет убыли своей внутренней энергии. Так как адиабаты ![]() не пересекаются, то состояние с
не пересекаются, то состояние с ![]() не может быть достигнуто никаким адиабатическим процессом, поэтому нельзя достигнуть ни в каком конечном процессе и абсолютный нуль температуры, совпадающей с
не может быть достигнуто никаким адиабатическим процессом, поэтому нельзя достигнуть ни в каком конечном процессе и абсолютный нуль температуры, совпадающей с ![]() ; к нему можно лишь асимптотически приближаться.
; к нему можно лишь асимптотически приближаться.
2) Термические коэффициенты обращаются в ноль при ![]() .
.
Термический коэффициент расширения 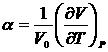 и термический коэффициент давления
и термический коэффициент давления 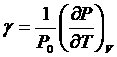 , как и вообще термодинамические величины
, как и вообще термодинамические величины 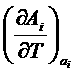 и
и 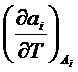 , характеризующие поведение системы при изменении температуры, могут быть получены дифференцированием соответствующих обобщенных сил
, характеризующие поведение системы при изменении температуры, могут быть получены дифференцированием соответствующих обобщенных сил ![]() по температуре, где
по температуре, где ![]() - соответствующий данной обобщенной силе независимый параметр.
- соответствующий данной обобщенной силе независимый параметр.
Используя первое начало ТЕРМОДИНАМИКИ, нетрудно убедится, что 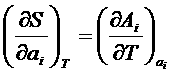 , а так как энтропия перестает зависеть от параметров состояния, то, следовательно, и термические коэффициенты обращаются в ноль.
, а так как энтропия перестает зависеть от параметров состояния, то, следовательно, и термические коэффициенты обращаются в ноль.
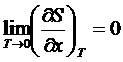 Þ
Þ 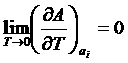 .
.
В частном случае если в качестве обобщенной силы ![]() выбираем
выбираем ![]() и соответственно,
и соответственно, ![]() , то
, то 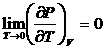 Þ
Þ ![]() при
при ![]() . Принимая в качестве обобщенных сил
. Принимая в качестве обобщенных сил ![]() поверхностное натяжение
поверхностное натяжение ![]() , ЭДС гальванического элемента и т.д. из формулы получаем, что все эти величины при
, ЭДС гальванического элемента и т.д. из формулы получаем, что все эти величины при ![]() перестают зависеть от температуры и следовательно, температурный коэффициент поверхностного натяжения
перестают зависеть от температуры и следовательно, температурный коэффициент поверхностного натяжения ![]() температурный коэффициент ЭДС и т.д. должны обращаться в нуль при приближении температуры к абсолютному нулю. (температурный коэффициент поляризации
температурный коэффициент ЭДС и т.д. должны обращаться в нуль при приближении температуры к абсолютному нулю. (температурный коэффициент поляризации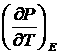 , намагниченности
, намагниченности 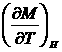 и т.д...). Эти выводы из III начала ТЕРМОДИНАМИКИ подтверждаются экспериментально.
и т.д...). Эти выводы из III начала ТЕРМОДИНАМИКИ подтверждаются экспериментально.
3) Вычисление энтропии и поведение теплоемкостей при ![]() .
.
Третье начало ТЕРМОДИНАМИКИ упростило вычисление всех термодинамических функций. До установления третьего начала для вычисления энтропии необходимо было знать температурную зависимость теплоемкости и термическое уравнение состояния.
Согласно третьему началу, энтропию можно находить, зная лишь зависимость теплоемкости от температуры и не располагая термическим уравнением состояния, которое для конденсированных тел неизвестно. Действительно из выражений для теплоемкостей 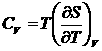 ,
, 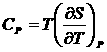 по третьему началу, интегрированием получаем:
по третьему началу, интегрированием получаем: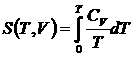 ,
, 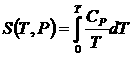
Важнейшая задача вычисления энтропии сводится к определению лишь температурной зависимости теплоемкости. По третьему началу энтропия при ![]() конечна, поэтому интегралы в формулах должны быть сходящимися. Это будет выполняться, если подынтегральные функции
конечна, поэтому интегралы в формулах должны быть сходящимися. Это будет выполняться, если подынтегральные функции ![]() на нижнем пределе возрастают медленнее, чем
на нижнем пределе возрастают медленнее, чем ![]() :
:
![]() поэтому
поэтому ![]() и,следовательно
и,следовательно![]()
теплоемкости стремятся к нулю быстрее, чем ![]() .
.
5) Вычисление энтропийной и химической постоянных идеальный газов.
Второе начало ТЕРМОДИНАМИКИ оставляет открытым вопрос о явном виде энтропийной и химической постоянных идеального газа. Знание этих постоянных необходимо при рассмотрении равновесия в различных системах (химические реакции, испарение и др.). Третье начало может быть косвенно использовано для решения этой задачи, хотя классический идеальный газ и не удовлетворяет третьему началу.
Идея вычисления состоит в том, что рассматривается условие равновесия газа и твердого тела одного и того же вещества (равенство химических потенциалов вещества в обеих фазах), в которое входят выражения энтропии, как газа, так и твердого тела. Энтропия твердого тела определяется формулами 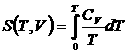 ,
,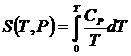 . Для энтропии идеального газа используется выражение
. Для энтропии идеального газа используется выражение ![]() . Энтропийная постоянная
. Энтропийная постоянная ![]() в уравнении связана с химической постоянной газа. Эти постоянные можно вычислить методами статистической физики.
в уравнении связана с химической постоянной газа. Эти постоянные можно вычислить методами статистической физики.
Поможем написать любую работу на аналогичную тему

