В качестве примера на определение конкретных условий равновесия, исходя из общих условий равновесия, рассмотрим изолированную двухфазную систему одного итого де вещества. Например, вода и ее пар. Для такой системы ![]() ,
, ![]() ,
, ![]() .
.
Если ![]() и
и ![]() энтропия соответственно первой и второй фаз, то энтропия системы
энтропия соответственно первой и второй фаз, то энтропия системы ![]() . Ее общее условие равновесия
. Ее общее условие равновесия ![]() .
.
Каждая из фаз представляет собой однокомпонентную систему с переменным числом частиц, и основными уравнениями термодинамики для них будут:
![]() и
и ![]() определим
определим ![]() и
и ![]() . Подставим в условие равновесия
. Подставим в условие равновесия
![]() ,
,
а т.к. система изолирована, то ее параметры подчиняются следующим уравнениям связи, в качестве независимых параметров выберем ![]() ;
;
![]() ,
, ![]() Þ
Þ ![]() Þ
Þ ![]() ;
;
![]() ,
, ![]() Þ
Þ ![]() Þ
Þ ![]() ;
;
![]() ,
, ![]() Þ
Þ ![]() Þ
Þ ![]() ;
;
изменение одной из компонент, например, ![]() приводит к такому же изменению с обратным знаком объема
приводит к такому же изменению с обратным знаком объема ![]() другой компоненты и т.д.
другой компоненты и т.д.
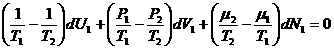 , отсюда в следствии независимости вариаций окончательно получаем следующие частные условия фазового равновесия однокомпонентной системы, т.е.равенство всех ТЕРМОДИНАМИКИ сил в обеих фазах:
, отсюда в следствии независимости вариаций окончательно получаем следующие частные условия фазового равновесия однокомпонентной системы, т.е.равенство всех ТЕРМОДИНАМИКИ сил в обеих фазах:
![]() - равенство температур фаз (условие термического равновесия);
- равенство температур фаз (условие термического равновесия);
![]() - равенство давлений в фазах (условие механического равновесия);
- равенство давлений в фазах (условие механического равновесия);
![]() - равенство химических потенциалов вещества в фазах (условие химического равновесия).
- равенство химических потенциалов вещества в фазах (условие химического равновесия).
Эти три условия можно записать в виде одного - ![]() , условия равенства химических потенциалов вещества в фазах при одинаковых температуре и давлении.
, условия равенства химических потенциалов вещества в фазах при одинаковых температуре и давлении.
Условие фазового равновесия показывает, что при равновесии двух фаз одного и того де вещества давление является функцией температуры, параметры ![]() перестают быть независимыми.
перестают быть независимыми.
Полученные условия фазового равновесия или справедливы только для однородных фаз, при отсутствии поля внешних сил. Если же фаза находится во внешнем поле (например, в поле сил тяжести), то при равновесии в обеих фазах одинаковы лишь температуры. Давление же и химический потенциал в каждой фазе является функциями координат.
Поможем написать любую работу на аналогичную тему
Реферат
Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
От 250 руб
Контрольная работа
Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
От 250 руб
Курсовая работа
Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
От 700 руб

