Химическое загрязнение окружающей среды и методы химического контроля химического загрязнения биосферы
Предприятия химической, целлюлозно-бумажной, оборонной, нефтеперерабатывающей промышленности, а также промышленности минеральных удобрений располагают крупными запасами вредных веществ. Значительные их запасы сосредотачиваются на объектах аграрного и хозяйственного секторов страны. При транспортных операциях с опасными грузами также проявляются многие виды опасностей: загрязнение окружающей среды, химическая активность, токсичность, коррозионностъ, радиоактивность, пожаро- и взрывоопасностъ. Для недопущения аварийных ситуаций необходимо учитывать химические свойства опасных веществ. Их знание и применение соответствующих методов дезактивации, нейтрализации позволит свести к минимуму последствия ликвидации аварийных ситуаций.
Загрязняющими биосферу веществами могут быть соединения практически всех элементов периодической системы элементов Д.И. Менделеева. Многие элементы имеют сходные свойства, и поэтому их удобнее рассматривать по группам, в которых элементы объединены по химическим или токсикологическим признакам.
Углерод и его соединения (СО, СО2)
Решение. Углерод (химический символ - C) - химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса природной смеси изотопов 12,0107 г/моль. Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых - антрацит (94-97 %), бурые угли (64-80 %), каменные угли (76-95 %), горючие сланцы (56-78 %), нефть (82-87 %), горючих природных газов (до 99 % метана), торф (53-56 % ), а также битумы и др.
В атмосфере и гидросфере находится в виде диоксида углерода
СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Токсичность. Оксид углерода представляет опасность для человека, прежде всего потому, что он может связываться с гемоглобином крови, а также тем, что он участвует в образовании смога. Кроме того, СО может образовывать высокотоксичные соединения — карбонилы.
При взаимодействии с гемоглобином (Нb) крови оксид углерода, как и кислород, занимает координационное положение в геме (гем − это комплексное соединение железа, в котором ион железа (II) соединен с протопорфириновой группой; гем входит в состав гемоглобина, его функция заключается в переносе кислорода). Сродство гемоглобина к СО в 200 − 300 раз выше, чем сродство к O2 (большой разброс значений данных объясняется, очевидно, существованием различных форм гемоглобина). Реакция гемоглобина (НЬ) с О2, как и реакция с СО, подчиняется закону действующих масс, поэтому, учитывая, что его сродство к СО в 300 раз больше, чем к О2, можно написать:
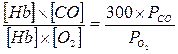
Подставляя в уравнение одинаковые количества × и
× , получаем: ,
![]() ИЛИ
ИЛИ 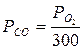
Поскольку объемная концентрация О2 в воздухе составляет около 20%, находим концентрацию СО:
![]()
необходимую для того, чтобы связать столько же гемоглобина, сколько связывает и атмосферный кислород. Иначе говоря, концентрация 0,066% (об.) в атмосфере достаточна для того, чтобы связать половину гемоглобина. В этом случае уже могут наблюдаться серьезные нарушения здоровья (см.табл.).
Скорость связывания с угарным газом СО зависит и от концентрации СО, интенсивности обмена веществ в организме человека, в том числе от частоты дыхания. В то время как насыщение гемоглобина оксидом углерода при объеме поступающего в легкие воздуха 10 л/мин с содержанием 0,1% (об.) СО достигается через 6 ч, при тяжелой работе и интенсивности дыхания 30 л/мин оно достигается уже менее чем через 2 ч
|
Признаки отравления при различном содержании комплекса Hb×СО в крови |
||
|
Концентрация СО в воздухе |
Содержание Hb×СО в крови |
Клинические симптомы |
|
60 млн -1 = 0,006% (об.) |
10% |
Ослабление зрения, легкая головная боль |
|
130 млн-1=0,013% (об.) |
20% |
Боли в голове и теле утомляемость, временная потеря сознания |
|
200 млн-1 =0,02% (об.) |
30% |
Потеря сознания, паралич, нарушение дыхания и жизнедеятельности |
|
660 млн -1 = 0,066% (об.) |
50% |
Полная потеря сознания, паралич, прекращение дыхания |
|
750 млн -1 = 0,075% (об.) |
60% |
В течение часа наступает летальный исход |
На горожанина-курильщика, особенно в закрытых помещениях, приходится двойная нагрузка: с одной стороны, действие СО, образующегося в результате выброса промышленными предприятиями и транспортом, с другой − СО, содержащегося в табачном дыме. В то время как у курильщиков − у промышленных рабочих в крови обнаружено в среднем 5% Hb×СО, у некурящих рабочих содержание не превышало Hb×СО 1,5%. Для уменьшения большой загазованности городов в I960—70-х гг. начали оборудовать в них зеленые пешеходные зоны.
Химическая активность. При обычных температурах углерод химически инертен. При достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300-500 °C, 600-700 °C и 850-1000 °C.
Действие на окружающую среду. Продукты горения углерода - оксид углерода CO и диоксид углерода СО2.
Оксид углерода (СО), образуется при неполном сгорании углеродсодержащих веществ. В незагрязненной атмосфере содержится около 60 млн. т оксида углерода. Небольшие количества оксида углерода природного происхождения образуются в результате вулканической деятельности окисления метана в атмосфере. Эта реакционная цепь пока не полностью не установлена, но, по-видимому, окисление осуществляется с помощью ОН*- радикалов. Исходным веществом для образования этих радикалов служит тропосферный озон, который под действием ультрафиолетового излучения с длиной менее 310 нм выделяет возбужденный кислород 0(1D). Этот возбужденный кислород в тропосфере с водяными парами образует радикалы ОН*. Радикалы ОН* окисляют метан в многостадийном процессе, где заключительной стадией является образование СО, который, видимо с помощью других радикалов ОН*, может превращаться в СО2. К естественным источникам образования СО добавляются антропогенные выбросы. Это связано в первую очередь с автотранспортом, так как у двигателей внутреннего сгорания оптимальные условия окисления топлива создаются только при выходе на определенный рабочий режим. Как правило, это соответствует 3/4 общей мощности двигателя; напротив, максимальные выбросы СО происходят на холостом ходу. Например, в 1988 г. для машины с объемом цилиндра 1400—1999 см3 при работе двигателя на холостом ходу выхлопные газы содержали 1,0—1,5 (об.) СО. Но, даже при условии, что в других промышленных странах с (высоким уровнем использования автотранспорта каждая автомашина выбрасывает в атмосферу в среднем такие же количества СО, в глобальном масштабе это составляет лишь небольшую величину. Еще меньше СО попадает в атмосферу за счет курильщиков (хотя и эти малые количества представляют опасность в местах большого скопления людей, где эффект разбавления проявляется в недостаточной степени). В больших городах, и области большого давления и температурной инверсии содержание СО может достигать 100 млн-1 и выше. Внутри помещений, где СО появляется в результате неполного сгорания топлива в печах и курения, его концентрация сможет доходить до 50 млн-1, что сопоставимо, с нормой МЭК (максимальная эмиссионная концентрация) о эмиссионной концентрации, составляющей 50см3/м3или 50млн-1.
Диоксид углерода (СО2). В отличие от оксида углерода диоксид углерода образуется при полном окислении углеродсодержащего топлива. Атмосферный СО2 находится в состоянии постоянного обмена с почвой, водами и живыми организмами, в результате чего создается постоянный кругооборот его в природе. Источниками СО2 служат вулканические извержения, выветривание содержащих углерод горных пород, микробиологический распад органических соединений над почвой и в почве, дыхание животных и растений, лесные пожары и сжигание природного топлива. Увеличение количества сжигаемого природного топлива с развитием индустриализации, особенно в течение последних 100 − 200 лет, привело к заметному повышению содержания СО2 в атмосфере. При сравнении состава современного воздуха с пробами 200-летней давности, взятыми в полостях арктических и антарктических льдов, было установлено, что, если в 1750 г. содержание СО2 составляло 280 млн., то за это время оно повысилось до 330−340 млн-1. За период с 1860 г. по 1978 г. ежегодный прирост выделяемого углерода составлял около 1млрд. т. Наряду с сжиганием природного топлива человек находит другой повод для вмешательства в природные «кладовые» углерода. В результате интенсивной обработки земли и создания новых пашен идет быстрое разрушение слоя гумуса в почве, и ускоренный переход углерода в атмосферу. К этому добавляется вырубка лесов, особенно ликвидация тропической растительности, которой издавна накопились огромные запасы углерода. Эти вырубки в значительной мере способствуют нарушению равновесия между связыванием и выбросом углерода. Пока еще не удалось количественно установить вклад в увеличение концентрации в атмосфере в результате вырубки лесов и ускоренного разрушения гумуса. Попавший в атмосферу СО2 остается в ней в среднем 2 − 3 года. За это время СО2 повсеместно распространяется по всей земной поверхности, входя в состав атмосферы. Влияние СО2 выражаётся не только в токсическом действии на живые органе и в способности поглощать инфракрасные лучи. При нагревании земной поверхности солнечными лучами часть тепла в виде инфракрасного излучения отдается обратно в мировое пространство. Это возвращаемое тепло частично перехватывается газами, поглощающими инфракрасное излучение, которые в результате нагреваются. Если это явление происходит в тропосфере, то с ростом температуры могут происходить климатические изменения («парниковый эффект»). Одна из основных проблем нашего времени состоит в том, чтобы определить масштабы и временные рамки климатических изменений в результате накопления тепла за счет СО2.
Поможем написать любую работу на аналогичную тему

