Во многих отраслях промышленности перерабатывают или применяют различные соединения ртути, хрома, кадмия, цинка, свинца, меди, никеля, мышьяка и другие вещества, что ведет к загрязнению ими сточных вод.
Для удаления этих веществ из сточных вод в настоящее время наиболее распространены реагентные методы очистки, сущность которых заключается в переводе растворимых в воде веществ в нерастворимые при добавлении различных реагентов с последующим отделением их от воды в виде осадков. Недостатком реагентных методов очистки является безвозвратная потеря ценных веществ с осадками.
В качестве реагентов для удаления из сточных вод ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия, сульфиды натрия, различные отходы, например феррохромовый шлак, который содержит (в %): СаО — 51,3; MgO — 9,2; SiO2 — 27,4; Сг2О3 — 4,13; А12О3 — 7,2; FeO — 0,73.
Наиболее широко используется гидроксид кальция. Осаждение металлов происходит в виде гидроксидов. Процесс проводится при различных значениях рН.
Значения рН, соответствующие началу осаждения гидроксидов различных металлов и полному осаждению (табл. 1), зависят от природы металлов, концентрации их в растворе, температуры, содержания примесей.
Таблица 1 – Значения рН в процессе осаждения гидроксидов металлов.
|
Вид катиона |
Значение рН |
|
|
начало осаждения * |
полное осаждение** |
|
|
Железо Fе2+ |
7,5 |
9,7 |
|
Железо Fе3+ Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к
профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные
корректировки и доработки. Узнайте стоимость своей работы.
|
2,3 |
4,1 |
|
Цинк Zn2+ |
6,4 |
8,0 |
|
Хром Gr3+ |
4,9 |
6,8 |
|
Никель Ni2+ |
7,7 |
9,5 |
|
Алюминий Аl3+ |
4,0 |
5,2 |
|
Кадмий Cd2+ |
8,2 |
9,7 |
|
* при исходной концентрации осаждаемого иона 0,01 моль/л |
||
|
** значения рН соответствуют остаточной концентрации металла 10−5 моль/л |
||
Например, при совместном осаждении двух или нескольких ионов металлов при рН = const достигаются лучшие результаты, чем при осаждении каждого из металлов в отдельности. При этом образуются смешанные кристаллы и происходит адсорбция на поверхности твердой фазы ионов металлов, благодаря чему достигается более полная очистка от некоторых металлов.
Очистка от соединений ртути. Сточные воды, загрязненные ртутью и ее соединениями, образуются при производстве хлора и едкого натра, в других процессах электролиза с использованием ртутных электродов, на ртутных заводах, в некоторых гальванических производствах, при изготовлении красителей, углеводородов, на предприятиях, использующих ртуть как катализатор.
В производственных сточных водах может присутствовать металлическая ртуть, неорганические и органические ее соединения. Неорганические соединения ртути: оксид — HgO, хлорид (сулема)— HgCl2, сульфат — HgSO4, сульфид (киноварь) — HgS, нитрат — Hg(NO3)2, цианид — Hg(CN)2, тиоцианат — Hg(NCS)2, цианат — Hg(OCN)2 и др. В неорганических соединениях токсичны главным образом ионы Hg2+, поэтому наиболее опасны хорошо растворимые и легко диссоциирующие соли.
Органические соединения ртути применяют при консервировании древесины, при синтезе металлорганических соединений, как ядохимикаты, для защиты пластических материалов, бумажной массы и текстиля, казеиновых клеев от плесневых грибков. Органические соединения ртути весьма токсичны и отличаются от неорганических солей тем, что не дают реакции на ионы Hg. В водоемах ртуть под влиянием органических соединений, содержащихся в природных водах, превращается в сильнотоксичные соединения. Предельно допустимая концентрация ртути в водоемах равна 0,005 мг/л.
Металлическая ртуть может быть удалена из сточных вод в процессах отстаивания или фильтрования. Частицы, прошедшие с фильтратом или не успевшие осесть, окисляют хлором или NaOCl до HgCl2. Затем воду обрабатывают восстановителем (NaНSO4 или Nа2SОз) для их удаления и связывания остатков свободного хлора. Ртуть осаждают сульфидом натрия с последующим коагулированием образующегося сульфида ртути хлоридом железа. Очистка может быть осуществлена смешанной солью — сульфидом железа и сульфатом бария.
Для выделения из сточных вод ртути используют методы восстановления: сульфидом железа, гидросульфидом натрия, гидразином, железным порошком, газообразным сероводородом и др. Широко изучаются сорбдиокные методы очистки от ртути. Весьма эффективным является ионный обмен с винилпиридиновыми сорбентами, емкость которых доходит до 40%. Наиболее распространенным способом удаления растворимых в воде соединений ртути является перевод их в труднорастворимый сульфид ртути и осаждение его.
Для осаждения Hg в сточные воды сначала добавляют сульфид натрия, гидросульфид натрия или сероводород. Затем обрабатывают воду хлоридами натрия, калия, магния, кальция или сульфитом магния в количестве 0,1 г/л. В этих условиях сульфид ртути осаждается в виде гранул. Для удаления тонкодисперсных коллоидных частичек сульфида ртути целесообразно добавлять коагулянты А12(5О4)3 · 18Н2О, FeSO4·7H2O и др.
Осадок сульфида ртути отделяют от сточных вод на вакуум-фильтрах или фильтр-прессах. Отделение HgS до остаточной концентрации 0,001 мг/л можно обеспечить и на угольных фильтрах. Отработанный уголь, содержащий сульфид ртути, сжигают в печи или подвергают обработке для рекуперации ртути. Для удаления из растворов соединений ртути можно использовать и свежеосажденный сульфид железа, который получают при взаимодействии ионов S2- с FeSO4·7H2O или FeCl3·6Н2О. Для очистки может быть применена и смесь сульфида железа с сульфатом бария при избытке сульфида железа. Растворенные неорганические соединения ртути можно восстанавливать до металлической ртути с последующим выделением из воды.
Кроме методов осаждения для очистки сточных вод от неорганических соединений ртути могут быть использованы и сорбционные методы.
Изучен процесс образования амальгамы ртути в электрическом поле. Способ пригоден для очистки сточных вод, содержащих от 0,01 до 100 мг/л соединений ртути. В этом процессе сточная вода фильтруется через слой стеклянных шаров, покрытых медью или цинком. Шары являются катодом, а наружный корпус аппарата — анодом. При регенерации фильтрующей загрузки производят переполюсовку электродов.
Органические соединения ртути сначала разрушают окислением, например газообразным хлором. После удаления избытка хлора катионы ртути восстанавливают до металлической или переводят в труднорастворимые сульфиды с последующим удалением осадка.
Очистка от соединений цинка, меди, никеля, свинца, кадмия, кобальта. Соли этих металлов содержатся в сточных водах горно-обогатительных фабрик, металлургических, машиностроительных, металлообрабатывающих, химических, химико-фармацевтических, лакокрасочных, текстильных и др. заводов.
При обработке кислых вод оксидом кальция и гидроксидом натрия ионы указанных тяжелых металлов, содержащиеся в стоках, связываются в труднорастворимые соединения. Состав солей зависит от рН среды. Так, при рН 7 осаждается гидроксид-сульфат цинка состава ZnSO4 ·3Zn(OH)2, а при повышении рН до 8,8 составу осадка соответствует формула ZnSO4 ·5Zn(OH)2. В сильнощелочной среде твердая фаза представляет собой в основном гидроксид.
При действии соды на сточные воды, содержащие соли цинка, образуются гидроксокарбонаты:
2ZnCl2+2Na2CO3+H2O → 4NaCl+CO2+(ZnOH2)CO3 ↓.
При значениях рН от 7 до 9,5 образуется основной карбонат состава 2ZnCO3 ·3Zn(OH)2, начиная с рН=10 доля гидроксида возрастает.
Хотя осаждение основных карбонатов начинается при более низких значениях рН, чем соответствующих гидроксидов, расход соды на осаждение выше, чем при использовании едкого натра или извести. Это объясняется тем, что при осаждении тяжелых металлов содой процесс идет через стадию образования гидрокарбонатов и для завершения реакции требуется избыток реагента.
Выделение диоксида углерода в результате осаждения содой ведет к тому, что пузырьки газа обволакивают частицы осадка и поднимают их, способствуя всплытию части осадка в отстойниках. Газ необходимо удалять продувкой воздухом по достижении рН = 4,5.
К недостаткам едкого натра и соды как реагентов следует отнести также их относительно высокую стоимость и дефицитность.
Очистка сточных вод от меди связана с осаждением ее в виде гидроксида или гидроксид-карбоната:
Си2++2ОН−→ Cu(OH)2, 2Cu2++2OH−+CO32− → (CuOH)2CO3↓.
Осаждение гидроксида меди происходит при рН = 5,3.
Возможен процесс извлечения меди из сточных вод осаждением ферроцианидом калия. Этот реагент может быть использован и для осаждения других ионов тяжелых металлов.
Для удаления из сточных вод меди и кадмия разработан процесс контактирования их с диоксидом серы или сульфатами и порошкообразным металлом, например цинком или железом. При этом металл восстанавливает сульфиты до сульфидов, которые с тяжелыми металлами образуют труднорастворимые сульфиды. При рН = 2 и температуре сточных вод 50 °С, при которых проводится процесс, достигается высокая степень очистки.
Очистка сточных вод от никеля основана на выделении его из раствора в виде труднорастворихмых соединений:
Ni2++2OH− → Ni(OH)2 ↓, 2Ni2++CO32−+2OH→ (NiOH)2CO3↓,
Ni2++CO32− → NiCO3 ↓.
Осаждение гидроксида никеля начинается при рН=6,7.
Находящиеся в растворе катионы свинца переводят в осадок в виде одного из трех труднорастворимых соединений:
РЬ2++2ОН−→ РЬ(ОН)2↓, 2РЬ2++2ОН−+СО32− → (РЬОН)2СО3↓,
РЬ2++СОз2− → РЬСО3↓.
Началу выпадения в осадок гидроксида свинца соответствует рН=6,0.
Концентрации ионов кобальта и кадмия в стоках обычно чрезвычайно малы по сравнению с содержанием катионов других тяжелых металлов. Произведение растворимости гидроксида кобальта равно 6,3·10−15, а гидроксида кадмия 2,2·10−14, рН среды при выпадении этих гидроксидов в осадок соответственно равен 6,7—7,7 и 7,2—8,2. Поэтому при обработке стоков известковым молоком они могут быть максимально очищены от растворенных солей кобальта и кадмия.
Несмотря на то, что в сточных водах обычно содержатся катионы нескольких металлов, применение для удаления каждого из них специфического осадителя метода невозможно. Поэтому сточную воду обрабатывают обычно гидроксидом кальция (известковым молоком), приготовляемым из извести III сорта; при этом происходит одновременное осаждение катионов тяжелых металлов в виде гидроксосолей, гидроксидов и карбонатов. Установлено, что при совместном осаждении нескольких металлов достигаются лучшие результаты, чем при осаждении каждого из металлов в отдельности. Это связано с образованием смешанных кристаллов и адсорбцией ионов металлов на поверхности твердой фазы.
Для повышения степени очистки сточных вод, содержащих тяжелые металлы, предложено после осаждения их гидроксидов известью при рН = 8,5 и отделения осадка вводить в осветленную сточную воду раствор Na2Si03 в количестве, в 5—30 раз превышающем стехиометрическую норму. После отделения осадка сточная вода с небольшим содержанием ионов тяжелых металлов может быть возвращена в систему оборотного водоснабжения.
Обработка сточных вод щелочными реагентами позволяет снизить содержание тяжелых металлов в растворе до величин, сопоставимых с ПДК для водоемов санитарно-бытового пользования. Однако когда требуется более глубокая очистка, например, при непосредственном сбросе в рыбохозяйственные водоемы, очистка щелочными реагентами не дает необходимого эффекта.
Более глубокая очистка от тяжелых металлов достигается при обработке сточных вод сульфидом натрия. Это связано с тем, что растворимость сульфидов тяжелых металлов значительно меньше растворимости любых других труднорастворимых соединений — гидроксидов и карбонатов.
Осаждение сульфидов происходит при более низком значении рН, чем гидроксидов и карбонатов. Например, сульфид цинка осаждается при рН=1,5, сульфиды никеля и кобальта при рН = 3,3.
Для удаления небольших количеств ионов тяжелых металлов возможно использовать пирит. Процесс можно проводить фильтрованием сточной воды через гранулированный пирит или непосредственным введением порошка в сточную воду. Кроме пирита для этой цели можно использовать сульфид любого другого нетоксичного металла, произведение растворимости которого больше произведения растворимости сульфида извлекаемого из сточной воды металла.
Поскольку гидроксиды и сульфиды тяжелых металлов образуют устойчивые коллоидные системы для интенсификации процесса их осаждения в сточные воды необходимо вводить коагулянты и флокулянты. Коллоидные частицы сульфидов имеют отрицательный заряд, поэтому для коагуляции сульфидов используют электролиты с многозарядными катионами — обычно сульфаты алюминия или трехвалентного железа. При коагуляции гидроксидов требуется электролит с многозаряднымн анионами, так как коллоидные частицы заряжены положительно. Хорошими коагулянтами гидроксидов являются сульфат-ионы. Помимо электролитной коагуляции на практике часто используют взаимную коагуляцию коллоидных растворов с противоположным зарядом частиц.
Для ускорения процесса коагуляции используют флокулянты, в основном полиакриламид. Добавка его в количестве 0,01% от массы сухого вещества увеличивает скорость выпадения; осадков гидроксидов металлов в 2—3 раза.
Схема реагентной очистки сточных вод от ионов тяжелых металлов с отделением осадков показана на рис. 12. Недостатком такой очистки является образование большого количества труднообезвоживаемого шлама. Кроме того, очищенная вода содержит большое количество солей кальция, поэтому ее трудно использовать в оборотном водоснабжении. Исходя из этого, предложено обрабатывать слив после отстаивания последовательно хлоридом кальция и содой. При этом происходит соосаждение карбонатов металлов с карбонатом кальция. Образующиеся кристаллические осадки карбонатов металлов имеют незначительный объем и легко обезвоживаются. Одновременно происходит умягчение воды слива, что создает возможность использования ее в системе оборотного водоснабжения.
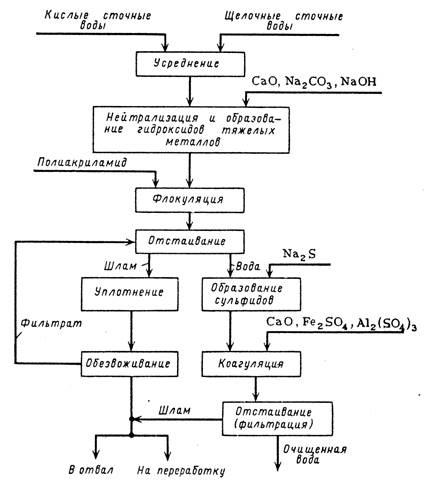
Рис. 12. Схема реагентной очистки сточных вод от ионов тяжелых металлов
Очистка от соединений мышьяка. Предельно допустимая концентрация мышьяка в водоёмах равна 0,05 мг/л. Для очистки сточных вод от мышьяка применяют реагентные, сорбционные, электрохимические, экстракционные и другие методы. Выбор метода зависит от формы растворенного мышьяка, состава, кислотности и других показателей воды.
Для очистки больших объемов воды с высоким содержанием мышьяка практическое применение нашел метод химического его осаждения в виде труднорастворимых соединений (арсенаты и арсениты щелочноземельных и тяжелых металлов, сульфиды и триоксид мышьяка).
Для очистки от кислородсодержащих соединений мышьяка широко применяют известковое молоко. При этом в зависимости от состава сточных вод и условий очистки (рН, температура, расход реагента) выпадают в осадок арсенаты и арсениты различного состава. Присутствие в сточных водах ионов тяжелых металлов повышает степень очистки от мышьяка, так как происходит осаждение арсенатов и арсенитов этих металлов.
Из сильнокислых растворов мышьяк осаждают сульфидом натрия, сероводородом. Очистку сульфидно-щелочных сточных вод от мышьяка, входящего в состав анионов тиосолей, приводят сульфатом железа (железным купоросом).
Соединения пятивалентного мышьяка удаляются из сточных вод лучше, чем трехвалентного. Кроме того, хранение осадков, содержащих пятивалентный мышьяк, дешевле, так как он менее токсичен и менее растворим. Исходя из этого, соединения трехвалентного мышьяка перед осаждением окисляют до пятивалентного. В качестве окислителей используют хлорную известь, хлор, гипохлоритную пульпу, пероксид водорода, азотную кислоту, озон, пиролюзит и др.
Очистка от солей железа. В природных водах содержание железа колеблется от 0,01 до 26 мг/л. Кроме того, железо содержится в сточных водах химических, металлургических, машиностроительных, металлообрабатывающих, нефтехимических, текстильных, химико-фармацевтических и других производств. При содержании железа более 1 мг/л вода приобретает бурый цвет. При движении такой воды по трубопроводам на их стенках откладываются соединения железа и железобактерии, уменьшая сечение трубопровода.
В водоемах ПДК солей железа в пересчете на Fe2+ равняется 0,5 мг/л. В то же время, в некоторых производствах технологическая вода и вода, находящаяся в обороте, не должна содержать соединений железа более 0,05 мг/л.
Для обезжелезивания вод применяют аэрацию, реагентные методы, электродиализ, адсорбцию, обратный осмос.
В процессе аэрирования происходит окисление двухвалентного железа в трехвалентное. Реакция окисления в водном растворе протекает по схеме:
4Fe2++O2+2H2O = 4Fe3++4OH−, Fe3++3H2O=Fe(OH)3+3H+
или суммарно
4Fe2++O2+10H2O=4Fe(OH)3+8H+.
Процесс аэрирования проводят в вентиляционной градирне. В том случае, когда необходимо обогащать воду кислородом и удалять часть свободного оксида углерода, используют градирни с хордовой насадкой, представляющей собой щиты из досок. Для приблизительной оценки размеров градирни можно исходить из следующего: расход воды на 1 м2 площади градирни 40 м3, расход воздуха 7 м3/м3 воды. Использование другой насадки нецелесообразно, так как может произойти ее забивка соединениями железа.
После аэрирования необходимо отделить осадок гидроксида железа. Для этой цели используют процессы отстаивания и фильтрования. Осадок гидроксида железа можно использовать для приготовления красок или для очистки газов от сероводорода.
При высоком содержании железа в воде аэрационным методом его полностью удалить нельзя, поэтому применяют реагентные методы. Для этой цели используют хлор, хлорат кальция (хлорную известь), перманганат калия, озон, оксид кальция (известь), карбонат натрия (соду) и др. Реагенты дозируются в воду перед осветлителями или отстойниками.
Очистка от соединений марганца. Соединения марганца содержатся в сточной воде металлургических, машиностроительных и химических производств. При концентрации марганца более 0,05 мг/л вода окрашивается в темный цвет.
Удаление из воды марганца может быть достигнуто следующими методами:
1) обработкой воды перманганатом калия;
2) аэрацией, совмещенной с известкованием;
3) фильтрованием воды через марганцевый песок или марганцевый катионит;
4) окислением озоном, хлором или диоксидом хлора.
Марганец может быть удален из воды биохимическим окислением. Процесс проводят следующим образом. На песке фильтра высеивают особый вид марганецпотребляющих бактерий, которые в процессе своей жизнедеятельности поглощают из воды марганец. Отмирающие бактерии образуют на зернах песка пористую массу с высоким содержанием оксида марганца, который служит катализатором процесса окисления.
Марганец из воды может быть удален при помощи марганцевого катионита, который приготовляют, пропуская через любой катионит в натриевой форме растворы хлорида марганца и перманганата калия.
В этих процессах перманганат калия окисляет марганец с образованием оксидов марганца, которые в виде пленки оседают на поверхность зерен катионита. При регенерации пленку восстанавливают раствором перманганата калия.
Из рассмотренных методов наиболее эффективным является метод обработки перманганатом калия. Он не требует сложного оборудования и просто контролируется.
Поможем написать любую работу на аналогичную тему

