Сжатие и расширение любого рабочего тела при обратимом проведении процесса может характеризоваться энергетическим и эксергетическим балансами. Рассмотрим в качестве примера процесс сжатия.
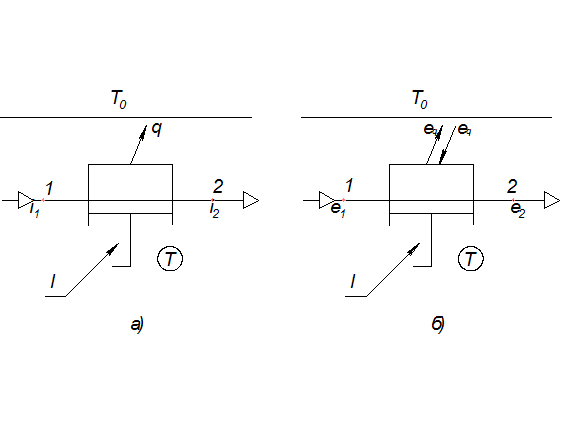 Рис. 4.2. Схема процесса сжатия.
Рис. 4.2. Схема процесса сжатия.
а – энергетический баланс
б – эксергетический баланс.
Пользуясь первым законом термодинамики и принимая во внимание, что D=0 и ΔE=0 (процесс обратимый и стационарный), получаем следующие уравнения:
Уравнение энергетического баланса:
![]()
Уравнение эксергетического баланса:
![]()
В зависимости от знака τe, определяемого соотношением температур T и T0 ,величина eq может быть как положительной, так и отрицательной.
Рассмотрим приведенные соотношения при T=T0. В этом случае τe = 0 и eq = 0, следовательно, l = e2 - e1, т. е. работа изотермического сжатия при температуре окружающей среды равна разности эксергий в начальном и конечном состояниях.
В диаграмме i-e изотермический процесс сжатия представляется следующим образом:
Т0
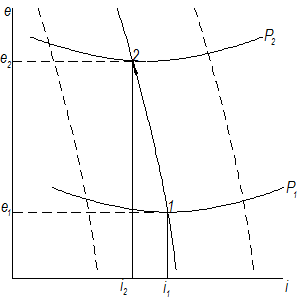
Рис.4.3. Процесс изотермического сжатия при Т = Т0
Из уравнения энергетического баланса следует, что изменение энергии газа равно разности между затраченной работой и отведённым теплом
![]() .
.
Для идеального газа эта величина равна нулю, поскольку его энергия не зависит от давления и отведённое в процессе сжатия тепло q равно затраченной работе l.
Для реального газа в общем случае l ≠ q и значение разности i2 - i1 определяется величиной изотермического дроссель-эффекта ΔiT, который при данной температуре равен ΔiT = i1 - i2 .
С учетом дроссель-эффекта уравнение энергетического баланса процесса сжатия:
l = q- ΔiТ
Выразим q из данного уравнения (q = l + ΔiT ) и подставим в уравнение эксергетического баланса l = e 2 - e1 + eq = Δe + q τe значения q и τe.
В результате подстановки получим:
![]()
Преобразуем:
![]()
Разделим уравнение почленно на ![]() , получим:
, получим:
или ![]()
![]()
и ![]()
Формулы для определения l и q действительны как при T>T0 так и при T<T0. Определив с помощью диаграммы i-e величину e и ΔiT, можно найти значения l и q.
Для идеального газа ΔiT = 0 и выражение для l и q сводится к формуле
![]()
Диаграмма i-e дает возможность производить расчеты, связанные с теплообменом. Для этого используют зависимость, связывающую эксергетическую температурную функцию и эксергию потока. Она получится следующим образом.
Рассмотрим е как функцию i, p.
Тогда
![]() ;
;
С другой стороны ![]() .
.
Расшифруем значение ds:
![]() и подставим в выражение для de
и подставим в выражение для de
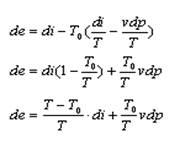
Сравним с de, получим ![]()
т.е. частная производная термомеханической эксергии потока по энтальпии при постоянном давлении равна эксергетической температурной функции.
Поскольку (∂i)p = δq, то с учётом уравнения eq = Σδq τе после подстановки получаем
(∂е)Р = δq τе = δeq.
Для конечного изобарного процесса
(Δе)Р = еq
Изменение эксергии потока рабочего тела е в изобарном процессе равно эксергии еq связанного с этим процессом теплового потока q.
Используя эту зависимость, можно найти эксергию тепла еq для любого изменения состояния при p=const.
Поможем написать любую работу на аналогичную тему

