Все модели исходили из того, что атом электронейтрален.
- Томсон в 1897 году создал первую модель атома.

Ø≈10-10 м
- Х. Нагаока в 1903 году представил себе расположение электронов в атоме подобно кольцам Сатурна.
- Резерфорд в 1911 сформулировал планетарную модель атома. Так в центре находится маленькое, но тяжелое ядро, а легкие электроны расположены на достаточно большом расстоянии от него.
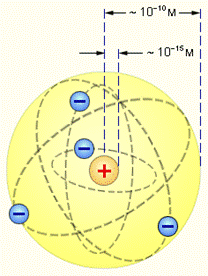
А. При вращении электрон излучает энергию и должен упасть на ядро. Вывод: атом является неустойчивым, а на самом деле в настоящее время атом является самой устойчивой из известных систем. В этом и есть первое и главное противоречие, если рассматривать атом с точки зрения классической механики.
Б. Должна непрерывно меняться частота, так как вращение равномерно, но у него непрерывный спектр излучения. Такой спектр ![]() дает вещество в твердом и жидком состоянии, на самом деле атом дает спектр
дает вещество в твердом и жидком состоянии, на самом деле атом дает спектр ![]()
Нильс Бор в 1913 году.
Постулаты:
I. Электроны в атоме могут двигаться только по определенным стационарным орбитам, и при этом энергия не излучается (Боровская орбита).
![]()
me – масса электрона
ve – скорость электрона
rn – радиус орбиты
![]()
Момент импульса электрона на боровской орбите равен примерно целому числу, причем, n≠0.
II. Атом излучает или поглощает квант энергии при переходе электрона из одного энергетического состояния в другое ( с одной орбиты на другую).
hn=E2-E1
E1 – стационарное энергетическое состояние электрона
E2 – энергия электрона в возбужденном состоянии.
Наименьшее энергетическое состояние электрона в атоме – на ближайшей к ядру орбите n=1. Данная формула объяснила линейчатые спектры атома.
Поможем написать любую работу на аналогичную тему

