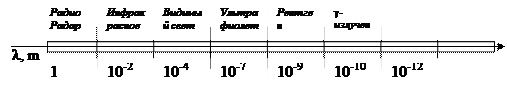
Радиоволны и радарное излучение в том случае, когда происходит изменение спина атома или ядра. Инфракрасное – за счет колебаний атомов в молекуле. Видимое, ультрафиолетовое – за счет квантовых переходов внешних электронов атома из возбужденного состояния в основное. Рентгеновское – за счет перехода электронов с внешних оболочек на внутренние. Гамма-излучение – связано с ядерными процессами и никак не связана с электронами.
Теория Бора является промежуточным звеном между классической и квантовой механикой.
Первый постулат был объяснен на основе уравнений де Бройля.
|
|
|
2πrn – длина окружности боровской орбиты.
Вывод: боровские (стационарные) орбиты – это такие орбиты, на которых укладывается целое число волн де Бройля.
Критерии применимости законов микро-, макро- и мегамира.
1. Макромир: Законы классической механики. Главный критерий: v<<c.
2. Мегамир: v®c. Релятивистская механика.
3. Микромир: Квантовая механика – постоянная Планка.
Гейзенберг в 1926 году выдвинул принцип неопределенности.
Для частиц, обладающих корпускулярно-волновым дуализмом нельзя одновременно определить точно и координату и импульс. Чем точнее определяется координата, тем менее точно можно определить импульс.
![]()
![]()
![]()
Δx – это неопределенность, или неточность, нахождения координаты импульса.
Δpx – неопределенность, или неточность нахождения самого импульса.
Если это произведение сравнимо с постоянной Планка, то поведение частицы описывается квантовой механикой. Если это произведение велико, то есть, много больше постоянной Планка, то поведение частицы описывается классической механикой.
Ни для какого движения в природе это произведение не будет меньше постоянной Планка.
![]()
Одновременное изменение энергии и среднее время жизни возбужденной частицы также нельзя измерить одновременно.
ΔE – средняя ширина энергетического уровня.
В 1926-м году Э. Шредингер вывел фундаментальное уравнение квантовой механики. Вывел волновое уравнение, в которое входит функция Ψ(x, y, z), зависящую от всех трех координат движения электрона и являющуюся аналогом амплитуды. Волновое уравнение Шредингера выведено из уравнения поперечной волны классической физики. Функция, как и амплитуда, может быть положительной и отрицательной.
Ψ2 представляет наибольший интерес. Квадрат волновой функции имеет определенный физический смысл. Квадрат функции характеризует вероятность нахождения электрона в данной точке атомного пространства с координатами x, y, z. Из уравнения Шредингера следует, что нельзя говорить о какой-то определенной боровской орбите, по которой движется электрон. Более правильно говорить об электронном облаке, а именно, о его наибольшей плотности в каком-то месте атома. И там, где плотность наибольшая, там и есть наибольшая вероятность нахождения данного электрона (ок. 90%). Пространство вокруг ядра, в котором наиболее вероятно находится электрон, называется орбиталью. Эти орбитали и есть решения уравнения Шредингера. Эти решения характеризуются тремя константами, которые Шредингер называл квантовыми числами n, l, m.
n – главное квантовое число, которое определяет размер атома (n от 1 до бесконечности) и показывает энергетический уровень электрона в атоме. Чем больше n, тем более высокой энергией обладает электрон. Если n>>1, то энергетический уровень образует не дискретный спектр, а сплошной, то есть, это уже объект макромира.
Принцип соответствия Бора: Законы квантовой механики при больших значениях квантовых чисел переходят в законы классической механики.
Вывод из этого принципа: всякая новая теория является развитием предыдущих теорий и полностью её не отвергает, а лишь указывает границы её применимости.
l – орбитальное (побочное или азимутальное) квантовое число. Характеризует (показывает) форму электронного облака и изменяется от 0 до (n-1), то есть, зависит от главного квантового числа. l определяет значение момента количества движения электрона по орбите.
![]()
l характеризует число подуровней на заданном энергетическом уровне.
Каждому значению l соответствует орбиталь особой формы.
Орбитали с l = 0 называются s-орбиталями,
l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 - d-орбиталями (5 типов),
l = 3 - f-орбиталями (7 типов).
m – магнитное квантовое число. Показывает ориентацию электронного облака в атоме при взаимодействии магнитного поля электрона с внешним магнитным полем и магнитными полями соседних электронов. m определяет число орбиталей на данном подуровне l (от –l до +l).
|
n=1 |
l=0(s) |
m=1 |
|
n=2 |
l=0(s), 1(p) |
m=1,3 m=-1,0,1 |
|
n=3 |
l=0(s),1(p),2(d) |
m=1,3,5 |
Три квантовых числа n, l и m определяют волновые свойства электрона (следует из решения уравнения Шредингера).
s – квантовое число, называемое спин.
![]()
Частица с целым спином.
Принцип Паули: В атоме не может быть электронов, у которых все квантовые числа равны. Это связано с тождественностью частиц. В атоме не может быть двух электронов в одинаковых энергетических состояниях.
Принцип дополнительности Бора (сформулирован в 1927-м году): Получение экспериментальной информации об одних физических величинах, описывающих частицу, неизбежно связано с потерей информации о других величинах, дополнительных к первой.
Eкин ® Епот
v®(x,y,z)
С точки зрения физика-экспериментатора это связано с влиянием макроприбора на микроскопический объект. С точки зрения квантовой механики определить одновременно основные свойства частицы и дополнительные к ним невозможно точно ни на каком приборе, так как частицы обладают корпускулярно-волновым дуализмом.
Принцип неопределенности Гейзенберга: увеличение точности определения положения частицы вызывает увеличение ошибки определения ее момента (энергии), если эти определения проводятся одновременно.
Принцип причинности (Связан с Лапласовским детерминизмом): Если мы знаем исходное условие (причину), то всегда можем определить следствие.
Квантовая механика основывается на теории вероятностей.
Ψ0®|Ψ|2 – Квадрат функции показывает наибольшую вероятность местоположения данной частицы.
Поможем написать любую работу на аналогичную тему

