Законы показывают переходы теплоты в работу. Изобретение паровых машин подтолкнуло развитие термодинамики. В 1848 году Джоуль впервые рассчитал эквивалент теплоты и работы 1 кал=4,187 Дж.
Термодинамическая система – это система, состоящая из большого числа частиц, взаимодействующих между собой. Термодинамические системы могут быть:
- Изолированными (замкнутыми) – это те системы, которые не сообщаются с окружающей средой ни работой, ни теплом, ни веществом, ни информацией. Другое название – равновесные.
- Открытые – сообщающиеся с окружающей средой. Открытые системы не изучаются классической термодинамикой.
Для замкнутых систем можно было применить наиболее простые расчётные уравнения, которые в некотором приближении подходили к описанию работы двигателей и тепловых машин. Параметры термодинамической системы: объем(V), работа(A), давление(P), температура(T), теплота(Q), внутренняя энергия тела(U).
Т является производной от энергии. Запас энергии всегда положителен, так как нельзя прекратить тепловое движение молекул, даже при Т=0 К остаются колебательные и вращательные движения.
Q – одна из форм энергии, определенное количество энергии, получаемое или передаваемое системой.
А определяется силой действия на систему. А=F·S, A=PΔV.
U включает в себя запас энергии атомов, молекул, электронов…
U=Uпоступ движ молек+Uядер+Ue+…
Без учёта Ек и Еп системы в целом!
Классическая термодинамика описывается тремя законами:
- Закон сохранения и превращения энергии.
Q=ΔU+A, где ΔU – изменение внутренней энергии.
Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и совершение телом работы.
Q=ΔU+PΔV.
- Невозможно получить работу без затрат энергии, то есть, невозможен вечный двигатель первого рода. Универсальный закон природы, справедливый для живых и неживых объектов.
1 кг жира ® 38,9 кДж
1 кг углеводов ® 17,5 кДж
1 кг белков ® 17,5 кДж
Применение первого закона к изопроцессам.
- Изохорный, V=const. A=0, Q= ΔU
- Изобарный, P=const. Q=ΔU+PΔV
- Изотермический, T=const. ΔU=0, Q=A.
- Адиабатный (протекающие без теплообмена), чаще всего – это быстротекущие процессы. Q=const. A=-ΔU
Теплоёмкость ![]() - это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.
- это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.

Это реальный необратимый процесс.
Обратимый процесс – это когда при его завершении (возврате в исходное состояние) система самопроизвольно возвращается к этому состоянию без каких-либо потерь. Это гипотетический цикл. К обратимому циклу можно приблизиться, если сделать процесс бесконечно медленным. Все обратимые процессы равновесны. На основании обратимого цикла С. Карно в 1827 году разработал так называемый цикл Карно – цикл работающей тепловой машины. Рабочее тело в цикле Карно – идеальный газ, и при работе такого цикла в машине нет потерь на трение, лучеиспускание и т.п. Тепловая машина, или тепловой двигатель, - это такое устройство, которое превращает внутреннюю энергию топлива в механическую.

Рабочее тело (газ, пар) при расширении совершает работу, при этом получает от нагревателя теплоту Q1. Далее сжимается, при сжатии рабочее тело передаёт холодильнику теплоту Q2. (Q1<Q2, T2<T1).
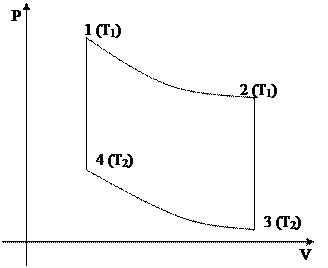
1-2 – изотермическое расширение газа с температурой T1. При этом газ получает от нагревателя Q1.
2-3 – дальнейшее расширение идеального газа с понижением температуры (адиабатное расширение).
В первых двух процессах совершается работа А.
3-4 – изотермическое сжатие.
4-1 – адиабатное сжатие газа с повышением температуры с T2 до Т1.
Цикл Карно – это обратимый процесс, идущий бесконечно медленно. По циклу Карно считают максимальный КПД (Коэффициент Полезного Действия).
Q1-Q2=Amax
![]()
![]() - означает, что КПД идеальной машины зависит только от температуры нагревателя и холодильника.
- означает, что КПД идеальной машины зависит только от температуры нагревателя и холодильника.
hобратим>hнеобратимого (самопроизв)
Формулировки второго закона.
Вся теплота никогда не может перейти в работу, часть ее обязательно теряется и передается холодильнику, потому что нельзя полностью исчерпать энергию теплового движения молекул. Можно работу превратить в теплоту. Нельзя создать вечный двигатель второго рода, то есть, нельзя создать такую тепловую машину, которая превращала бы всю теплоту в работу. Обязательно КПД<100%.
Второй закон термодинамики носит статистический, то есть, вероятностный характер, так как он выписан только для системы из большого числа молекул.
Энтропия – это количественная мера той теплоты, которая не переходит в работу.
S2-S1=ΔS=![]()
![]()
Если процесс обратимый, то ![]()
Энтропия (S) в реальном процессе – затраты на холодильник, лучеиспускание, трение. При обратимом изолированном цикле нет изменения энтропии, она постоянна. В необратимых процессах энтропия возрастает до тех пор, пока система не придет в равновесие, и при этом энтропия будет максимальна. Работа прекращается в состоянии равновесия, A=0. Отсюда Клаудиус вывел возможность тепловой смерти вселенной, так как идёт процесс накопления (повышения) энтропии, и все процессы остановятся, но его (возможно) ошибка была в том, что он исходил из того, что вселенная – замкнутая система.
Энтропия определяет возможность, направление и предел самопроизвольных процессов в замкнутых системах. Энтропия – это количественная мера хаоса в системе.
Больцман:
d=khW – показывает меру беспорядка, или хаоса.
W - Термодинамическая вероятность системы – это число микросостояний, соответствующих данному макросостоянию системы: число способов реализации данного макросостояния.
Если W=1, то S=0 – только идеальный кристалл при Т=0.
Энтропия идеального кристалла при Т=0 равна нулю. Если в кристалле есть хотя бы один дефект, то W=2, и S>0. Sгаза>Sжидк>Sтв.тела
Поможем написать любую работу на аналогичную тему

