* Способность к взаимодействию различных реагентов определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций.
* К условиям протекания химических процессов относятся термодинамические (характеризующие зависимость реакции от температуры, давления, энтропии и т.п.) и кинетические факторы.
* Термодинамическое взаимодействие влияет преимущественно на направленность и энергетическую составляющую реакции. Опирается теория этих воздействий на первое и второе начала термодинамики и на принцип Ле-Шателье.
Для примера рассмотрим несколько простейших реакций:
1. Необратимые реакции: реакция горения углерода
Cr + О2 + Q0 ![]() CО2
CО2![]() + Q; Q>Q0
+ Q; Q>Q0
Выделяется много тепла - экзотермическая реакция (Q>Q0), а энтропия системы при этом убывает, но не самопроизвольно (есть начальное нагревание Q0)
2. Самопроизвольные (и необратимые) реакции: реакция разложения перекиси водорода
2Н2О2→2Н2О+О2↑
Чтобы узнать энергетическую составляющую, надо знать энергии разрыва связей. Что же касается энтропии, то энтропия возрастает, так как Н2О2 – более упорядочена.
3. Обратимые реакции: реакция горения водорода в кислороде:
2Н2+ O2+Q0→2H2О+Q; Q > Q0;
реакция разложения воды при электролизе:
2H2О + Q0→2H2↑+О2↑+Q; Q0 > Q.
Обратим внимание, что обратимость реакции реализуется только при сообщении реагентам некоторого количества теплоты, т.е. реализуется подвижное равновесие. Подвижное равновесие определяет принцип Ле-Шателье:
а) при увеличении (уменьшении) концентрации любого из веществ равновесие смещается в сторону его расходования (образования);
б) увеличение (уменьшение) температуры смещает равновесие в сторону
эндотермической (экзотермической) реакции;
в) повышение давления увеличивает концентрации газообразных веществ, находящихся в равновесной системе в меньшем объеме.
Химическим равновесием называется состояние, в котором скорость обратной реакции равна скорости прямой реакции. Количественной характеристикой является константа химического равновесия, равная отношению произведения равновесных концентраций продуктов реакции и исходных веществ.
Скорость химических реакций при постоянной температуре пропорциональна произведению концентрации реагирующих веществ — закон действующих масс:
![]() !!!
!!!
Для приближенной оценки температурной зависимости константы скорости (коэффициента пропорциональности, не зависящего от концентрации реагирующих веществ) используется правило Вант-Гоффа: при повышении температуры на 10º скорость гомогенной реакции возрастает в γ раз:
![]()
Зная величину γ, можно рассчитать изменение скорости реакции при изменении температуры от T1 до Т2 по формуле:
![]()
Причина повышения скорости реакции при увеличении температуры была установлена С.Аррениусом.
Закон сохранения энергии не позволяет всем реагентам (молекулам) соединиться друг с другом; существует некоторый энергетический барьер (определяемый количеством связей, порядком расположения атомов), только преодолев который, вещества вступят в реакцию (см. схему 44)
Схема 44. Потенциальный барьер химической реакции.
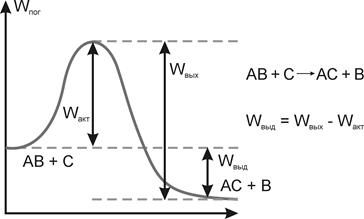
С. Аррениус доказал, что в реакцию могут вступать только те молекулы (реагенты), которые обладают избыточной энергией, т.е. активные молекулы. При обычной температуре их доля увеличивается в соответствии с правилом Вант-Гоффа. Энергия активации - высота максимума (горба) на кривой потенциальной энергии взаимодействия реагентов (двух атомов или молекул). Обычно, энергия активации гораздо больше тепловой энергии движения атомов (молекул) КбT. Тогда закон Аррениуса записывается в виде:
![]() , т.е. он определяет долю атомов (молекул), способных прореагировать.
, т.е. он определяет долю атомов (молекул), способных прореагировать.
В XX веке особую роль приобрела физическая химия цепных химических реакций: большинство реакций идет не прямо, а через промежуточные продукты, потому что при этом значительно понижается энергия активации. Она уменьшается особенно заметно, если атомы или соединения, входящие в промежуточные реакции, имеют свободные, ненасыщенные валентности. Такие атомы и соединения называются радикалами. Их обычно обозначают точкой над химическим символом.
Академик Н.Н.Семенов открыл в 1926-1932гг класс цепных реакций, где взамен одной валентности (радикала) получается несколько валентностей. В 1956г за эти работы ему была присуждена Нобелевская премия по химии. Особую роль в учении о химических процессах приобрел катализ, который позволил перебросить мостик от классической к неклассической (квантовой) химии и эволюционной химии.
Катализ определяет положительное воздействие на химический процесс, а ингибирование определяет сдерживающий процесс.
Катализом обычно называют ускорение химической реакции в присутствии веществ – катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав конечного продукта. Различают гомогенный и гетерогенный катализы, а также ферментный катализ и автокатализ.
Гомогенный катализ - катализ, который происходит либо в газовой смеси, либо в растворе, в котором растворены как катализатор, так и реагенты.
Гетерогенный катализ - катализ, при котором химическая реакция совершается в поверхностных слоях на границе раздела твердого тела, который обычно и выполняет роль катализатора, и газообразной или жидкой смеси реагентов.
Ферментный катализ - катализ, в котором в качестве катализаторов используются ферменты, как природные, так и искусственные сложнейшие молекулярные системы - биологические катализаторы.
Автокатализ - катализ, в котором в качестве катализатора выступают те или иные продукты химической реакции.
Катализ играет решающую роль в процессе перехода от химических систем к биологическим.
Поможем написать любую работу на аналогичную тему

