Состав воды
Вода — химическое соединение кислорода и водорода, которое принято обозначать формулой H2O. На самом деле вода имеет более сложный состав, и химическая природа ее до сих пор окончательно не установлена. Молекулярная масса воды равна 18, но встречаются молекулы с молекулярной массой 19, 20, 21 и 22. Они состоят из более тяжелых атомов водорода и кислорода, имеющих атомную массу соответственно более 1 и 16. У водорода два стабильных изотопа: протай (Н) и дейтерий (D); отношение Н: D составляет около 6700. Кроме того, известен еще один радиоактивный изотоп водорода с периодом полураспада 12,26 лет — это тритий (Т).
Одной из особенностей строения молекулы воды является несимметричное расположение атомов водорода вокруг атома кислорода: они расположены не по прямой, проведенной через центр атома кислорода, а под углом (рис. 1). Центры ядер атомов водорода расположены на расстоянии 9,5*10-8 см от центра атома кислорода. Угол между линиями, соединяющими центры атомов кислорода и водорода, равен 104,5°. Связь между атомами кислорода и водорода в молекуле воды осуществляется электронами. Вследствие несимметричности распределения электрических зарядов молекула воды обладает полярностью, т. е. имеет два полюса — положительный и отрицательный, которые так же, как и магнит, создают вокруг нее силовые поля.
Таким образом, для молекулы воды характерно дипольное строение (диполи). Их изображают в виде овалов, полюса которых имеют противоположные по знаку электрические заряды. При достаточном сближении молекулы воды начинают действовать друг на друга своими силовыми полями. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный другой. В результате могут получиться агрегаты из двух, трех и более молекул (рис. 2).
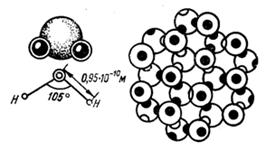
Рис. 1. Положение ядер водорода относительно атома кислорода в молекуле воды.
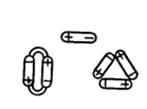
Рис. 2. Образование диполями воды ассоциированных молекул (дигидроля).
Вода, универсальный растворитель и проявляет эти свойства намного сильнее других жидкостей. Благодаря своей подвижности и текучести, вода способна подниматься по капиллярам на много тоньше человеческого волоса. Эта потрясающая способность позволяет ей подниматься из недр земли к поверхности, перемещаться от корней деревьев к кроне, заполнять мельчайшие трещины в горных породах. А затем, замерзая, раскалывать их.
Вода, внешне мягкая, податливая разрушает горные хребты любой твердости, возвращая окаменевшие породы к жизни, разрушая их, измельчая, превращая снова в плодородную почву. Это просто вопрос времени.
Вода, универсальный растворитель, ускоряет большой круговорот в живой природе процессом измельчения твердых веществ, становится поставщиком микроэлементов, так необходимых для жизни всего живого: растений, животных, человека.
Вода самый сильный универсальный растворитель на планете. И если у нее достаточно времени, она способна растворить любое самое твердое вещество. Она не только принимает форму сосуда, в котором находится, но и содержит, всегда, растворенный материал сосуда. Поэтому, еще не кому не удавалось получить абсолютно чистую (химически чистую), без примесей воду.
Растворяя вещества, вода, в большинстве случаев, химически не изменяется и не изменяет вещества, которые в ней растворились. Это характеризует воду, как универсальный инертный растворитель, что очень важно для всех живых организмов на Земле.
Если воду поместить во внешнее электрическое поле, то ее молекулы под действием поля стремятся расположиться в пространстве так, как показано на рис. 2.6. Это явление называется ориентационной поляризацией, ею обладают вещества с полярными молекулами. Высокая полярность молекул воды является одной из важнейших причин ее высокой растворяющей способности по отношению ко многим веществам, что позволяет образовывать с ними однородные физико-химические системы переменного состава (растворы). Растворенные в природных водах соли находятся в диссоциированном состоянии, в виде ионов. В твердом кристаллическом состоянии ионные соединения состоят из расположенных определенным образом положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Например, в галите, как это определено рентгеновским структурным анализом, каждый ион Na* окружен шестью ионами СГ, а каждый ион СГ — шестью ионами натрия. Ионы взаимодействуют между собой, притягивая друг друга (ионная связь).
Механизм растворения можно описать следующим образом. Молекулы воды в силу особенностей своего строения и возникающего из-за этого вокруг них силового поля обладают способностью притягивать молекулы других веществ. При соприкосновении с водой какой-нибудь соли ионы, образующие ее кристаллическую решетку, будут притягиваться противоположно заряженными частями молекул воды. Например, при погружении в воду кристаллов галита ион натрия (катион) будет притягиваться отрицательным полюсом молекулы воды, а ион хлора (анион) — положительным (рис. 2.7). Чтобы ионы кристаллической решетки оторвались друг от друга, и перешли в раствор, необходимо преодолеть силу притяжения этой решетки. При растворении солей такой силой является притяжение ионов решетки молекулами воды, характеризуемое так называемой энергией гидратации. Если энергия гидратации будет по сравнению с энергией кристаллической решетки достаточно велика, ионы оторвутся от решетки и перейдут в раствор.
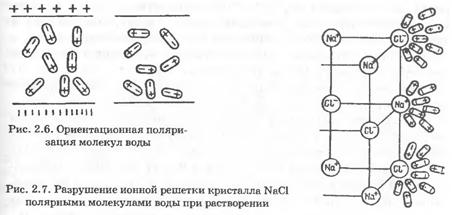
Ионы растворенного вещества притягивают и удерживают вокруг себя определенное число молекул воды, которые образуют оболочку, называемую гидратной. Таким образом, в водном растворе ионы являются гидратированными, то есть химически связанными с молекулами воды. Степень гидратации иона может быть различной в зависимости от плотности заряда — чем она выше, тем сильнее гидратирован ион. Катионы, имеющие меньший ионный радиус, чем анионы, гидратируются сильнее.
При кристаллизации многих солей часть гидратной воды захватывается кристаллическими решетками. Подобную кристаллизационную воду содержат гипс CaS04- 2Н20; мирабилит Na^SO* • 10Н20; би - шофит MgCl2 • 6Н20; сода Na2C03 • 10Н20. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами.
Поможем написать любую работу на аналогичную тему

