Из закона Рауля следует, что растворы нелетучих веществ обладают некоторыми особенностями, которые будут рассмотрены в этом параграфе.
Изученные закономерности для давления насыщенного пара в приложении к указанным разбавленным растворам нелетучих веществ дают возможность вычислить температуру кипения раствора.
Жидкость начинает кипеть, когда давление ее насыщенного пара становится равным внешнему давлению. Так как пар раствора нелетучего вещества фактически содержит лишь чистый растворитель, то, в соответствии с законом Рауля, давление насыщенного пара такого раствора будет всегда меньше давления насыщенного пара чистого растворителя при той же температуре.
Рис.10. Повышение температуры кипения раствора.
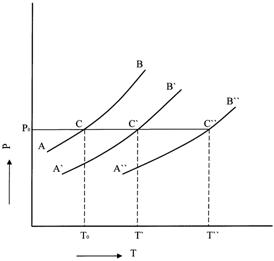
На рис.10 схематически изображены зависимости давления насыщенного пара чистого растворителя (АВ) и растворов разной концентрации x’ и x’’(кривые A'В' и А''В" соответственно ) от температуры, причем x’< x’’. Как видно из рисунка, температура кипения раствора Т', отвечающая точке С' пересечения кривой А'В' с изобарой внешнего давления P0, всегда выше температуры кипения растворителя Т0 при том же давлении (точка С). Температура кипения раствора большей концентрации x’’, отвечающая точке С’’ пересечения кривой А’’В’’ с изобарой внешнего давления P0, выше температуры кипения растворителя Т0 и выше температуры кипения T’ раствора меньшей концентрации.
Разность между температурой кипения раствора (Т)
и температурой кипения чистого растворителя DТ = Т - Т0 ,очевидно, тем больше, чем больше концентрация растворенного вещества. Пусть раствор настолько разбавлен, что он подчиняется закону Рауля (предельно разбавленный раствор). Тогда количественная зависимость DT от концентрации раствора при давлении насыщенного пара раствора, равном постоянному внешнему давлению: P1
= ![]() = Р = const, выражается следующим образом:
= Р = const, выражается следующим образом:
![]() (V, 7),
(V, 7),
где М – моляльность раствора, а величина E постоянна для каждого растворителя и носит название эбуллиоскопической постоянной. Она не зависит от природы растворенного вещества. Формально эта величина равна повышению температуры кипения раствора одного моля вещества в 1000 г растворителя (М = 1) и называется также молекулярным повышением температуры кипения. В табл.2 приведены значения эбуллиоскопических постоянных некоторых жидкостей.
Уравнение (V, 7) дает возможность вычислить молекулярную массу растворенного вещества, если известно повышение температуры кипения DT раствора, а также массы растворенного вещества и растворителя.
Метод определения молекулярной массы по уравнению (V, 7) называется обычно эбуллиоскопией.
Поможем написать любую работу на аналогичную тему
Реферат
Молекулярное повышение температуры кипения. Ограниченная взаимная растворимость жидкостей.
От 250 руб
Контрольная работа
Молекулярное повышение температуры кипения. Ограниченная взаимная растворимость жидкостей.
От 250 руб
Курсовая работа
Молекулярное повышение температуры кипения. Ограниченная взаимная растворимость жидкостей.
От 700 руб

