РАСТВОРИМОСТЬ ТВЕРДЫХ ВЕЩЕСТВ.
Твердое вещество не может беспредельно растворяться в жидкостях : при достижении некоторой концентрации, определенной при данных Р и Т, твердое вещество перестает растворяться; устанавливается равновесие между раствором и твердым веществом. Раствор, находящийся в равновесии с твердым веществом, называется насыщенным раствором, а его концентрация – растворимостью твердого вещества.
Химические потенциалы растворенного вещества в насыщенном растворе (mнас) и в твердой фазе (mт) имеют одно и то же значение :
mнас = mт
m2 = m2о + RT ln a2 ; m2, нас = m2о + RT ln a2, нас
m2, нас – mт = m2о + RT ln a2, нас – mт = 0
– RT ln a2, нас = m2о – mт = DG
DG = DH + T ![]() – уравнение Гиббса-Гельмгольца
– уравнение Гиббса-Гельмгольца
Растворение твердого вещества в жидкости можно представить как два последовательно протекающих процесса : 1) плавление твердого вещества; 2) смешение двух жидкостей. В случае идеальных растворов теплота 2-го процесса равна 0. Теплота 1-го процесса – теплота плавления твердого вещества DН2, пл .
Если при расчете а2 в качестве стандартного состояния 2-го компонента принята чистая жидкость, то m2о соответствует этому состоянию, а DG = m2о – mт равно изменению G для плавления 1 моля чистого 2-го компонента при Т ниже Т плавления; соответственно DН = DН2, пл .
– RT ln a2, нас = DН2, пл + Т
DН2, пл = RT2 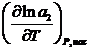
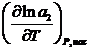 =
= ![]()
Для идеальных растворов : а2 = N2 = N
d lnN = ![]() dT
dT
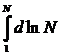 =
= ![]()
![]()
To – Т плавления 2-го компонента (N = 1); Т < То
lnN = – ![]() (
(![]() –
– ![]() ) = –
) = – ![]() + B
+ B
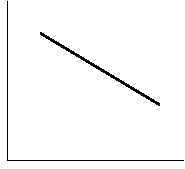
(линейная зависимость lnN от 1/Т). В это уравнение не входят величины, характеризующие растворитель Þ идеальная растворимость вещества не зависит от природы растворителя.
|
lnN
1/T |
По вышеприведенному уравнению и по графику можно рассчитать DН2, пл ; в случае идеальной растворимости (например, раствор нафталина в нитробензоле) она приблизительно равна экспериментально найденным другими методами DН2, пл . |
Отклонения от идеальной растворимости. Растворимость твердых веществ в жидкостях ЗАВИСИМОСТЬ от Т.
Растворимость в реальных растворах сильно отличается от идеальной. Вещества сходной химической природы нередко имеют совершенно различные растворимости в том или ином растворителе.
Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
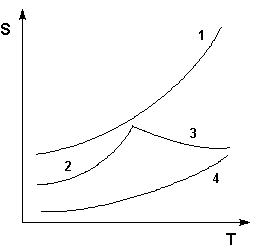
Рис. 2. Кривые растворимости некоторых солей в воде.
1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4, 4 – Ва(NО3)2.
Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости (рис. 2). Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье – Брауна).
Поможем написать любую работу на аналогичную тему
Реферат
Растворы твердых веществ в жидкостях. Зависимость растворимости от температуры.
От 250 руб
Контрольная работа
Растворы твердых веществ в жидкостях. Зависимость растворимости от температуры.
От 250 руб
Курсовая работа
Растворы твердых веществ в жидкостях. Зависимость растворимости от температуры.
От 700 руб