Второй закон Рауля.
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Изложенные факты и закономерности, относящиеся к растворимости твердых тел в жидкостях, охватывают и выделение твердого растворителя при охлаждении.
В самом деле, температура затвердевания раствора с малой концентрацией растворенного вещества (точнее, температура начала затвердевания) обычно есть не что иное, как температура, при которой этот раствор становится насыщенным относительно твердого растворителя.
При температуре начала затвердевания раствор и твердый растворитель находятся в равновесии, при этом давления насыщенного пара растворителя над раствором и над твердым растворителем должны быть равны. Так как давление пара растворителя над раствором всегда меньше, чем давление пара над чистым жидким растворителем при той же температуре, то раствор будет затвердевать при более низкой температуре, чем растворитель. Это видно из рис.11.
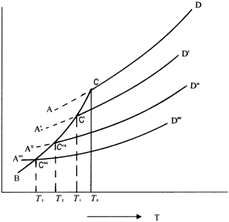
Рис.11. Понижение температуры затвердевания растворов.
На этом рисунке кривая AD показывает зависимость давления насыщенного пара чистого жидкого растворителя от температуры, кривая ВС - давление пара чистого твердого растворителя, кривые A'D', A" D" и А'"D"' - давление пара растворителя над растворами нелетучего вещества с постоянными концентрациями х'<х"<х'" и т. д.
Точки пересечения кривых AD, A'D', A"D" и т. д. с кривой ВС определяют температуры начала затвердевания соответственно чистого жидкого растворителя (Т0) и растворов (T1, Т2 и т. д.). Из рисунка видно, что понижение температуры начала затвердевания раствора (Т) по сравнению с температурой начала затвердевания чистого растворителя DT = Т0 - T становится более значительным по мере увеличения концентрации раствора.
Количественная зависимость между понижением температуры начала затвердевания раствора и концентрацией определяется из уравнения:
![]() (V, 8)
(V, 8)
Константа К характерна для данного растворителя и зависит только от его свойств. Физический смысл этой константы таков: она равна понижению температуры затвердевания, которое наблюдалось бы в растворе одного моля вещества в 1000 г растворителя (при условии сохранения свойств предельно разбавленного раствора до этой концентрации).
Константа K называется молекулярным понижением точки затвердевания раствора. Уравнение (V, 8 ) дает возможность определить молекулярную массу растворенного вещества по понижению точки затвердевания DT раствора этого вещества, содержащего m граммов его в 1000 г растворителя.
Правильные результаты получаются, естественно, при отсутствии диссоциации или ассоциации молекул растворенного вещества в разбавленном растворе. Изучение температур затвердевания растворов называют криоскопией, а метод определения молекулярных масс по уравнению (V, 8) - криоскопическим. Константа К поэтому называется также криоскопической константой. В табл.3 приводятся криоскопические константы некоторых растворителей.
Для повышения точности измерения DT удобно пользоваться растворителями с высокими значениями K , например, камфорой.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Активность была предложена в 1907 году Льюисом как новая переменная, применение которой вместо концентрации позволяет использовать для описания свойств реальных растворов относительно простые уравнения, полученные для идеальных систем. Альтернативой этому пути является использование более сложных уравнений, учитывающих взаимодействие между частицами (см., например, уравнение Ван-дер-Ваальса).
Активность отличается от общей концентрации на некоторую величину. Отношение активности (![]() ) к общей концентрации вещества в растворе называется коэффициентом активности:
) к общей концентрации вещества в растворе называется коэффициентом активности:
![]()
Поможем написать любую работу на аналогичную тему

