Типы кристаллических решеток
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов.
Кристаллические решётки: ионные, ковалентные, металлические, молекулярные.
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
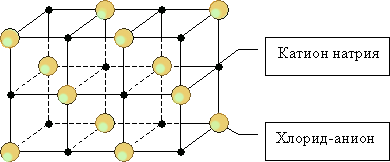
Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO3−, сульфат-ион SO42−, карбонат-ион CO32−.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Большинство ионных соединений кристаллизуется по одному из структурных типов, которые отличаются друг от друга значением координационного числа, то есть числом соседей вокруг данного иона (4, 6 или 8). Для ионных соединений с равным числом катионов и анионов известно четыре основных типа кристаллических решеток: хлорида натрия (координационное число обоих ионов равно 6), хлорида цезия (координационное число обоих ионов равно 8), сфалерита и вюрцита (оба структурных типа характеризуются координационном числом катиона и аниона, равным 4). Если число катионов вдвое меньше числа анионов, то координационное число катионов должно быть вдвое больше координационного числа анионов. В этом случае реализуются структурные типы флюорита (координационные числа 8 и 4), рутила (координационные числа 6 и 3), кристобалита (координационные числа 4 и 2).
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Высокая растворимость в полярных растворителях, сопровождающаяся электролитической диссоциацией обусловлена тем, что в среде растворителя с высокой диэлектрической проницаемостью ε уменьшается энергия притяжения между ионами. Диэлектрическая проницаемость воды в 82 раза выше, чем вакуума (условно существующего в ионном кристалле), во столько же раз уменьшается притяжение между ионами в водном растворе. Эффект усиливается за счет сольватации ионов. Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Межмолекулярные силы возникают за счет электростатического взаимодействия отрицательно заряженных электронов одной молекулы с положительно заряженными ядрами соседних молекул. На силу межмолекулярного взаимодействия влияет много факторов. Важнейшими среди них является наличие полярных связей, то есть смещения электронной плотности от одних атомов к другим. Кроме того, межмолекулярное взаимодействие проявляется сильнее между молекулами с большим числом электронов.
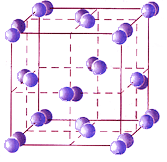 Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
 Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
Анизотропия
Анизотропия свойств ,кристаллов вызвана анизотропией их пространственной решетки. Это значит, что разные грани, ребра, вершины кристалла имеют различные свойства: по-разному блестят, твердость кристалла на них различна, нередко они имеют иную окраску и т. д. Анизотропия свойств выражается в том, что по непараллельным направлениям свойства на одной и той же грани различны. Например, грани кристаллов алмаза царапаются в разных направлениях по-разному – это учитывается при шлифовке бриллиантов. Анизотропно проявляются в объеме кристалла все физические свойства: оптические, электрические, теплофизические свойства, твердость и др.
Монокристаллы и поликристаллы
Кристаллические тела могут быть монокристаллами и поликристаллами. Монокристаллом называют одиночный кристалл, имеющий макроскопическую упорядоченную кристаллическую решётку. Монокристаллы обычно обладают геометрически правильной внешней формой, но этот признак не является обязательным.
Большинство встречающихся в природе и получаемых в технике твердых тел представляют собой совокупность сросшихся друг с другом хаотически ориентированных маленьких кристаллов - кристаллитов. Такие тела называются поликристаллами. В отличие от монокристаллов поликристаллы изотропны, т. е. их свойства одинаковы во всех направлениях.
Полиморфизм
Многие вещества в кристаллическом состоянии могут существовать в двух или более фазовых разновидностях (модификациях), отличающихся физическими свойствами. Это явление называется полиморфизмом. Каждая модификация устойчива в определенном интервале температур и давлений.
Упорядоченное расположение атомов или молекул в кристалле определяется действием сил межатомного или межмолекулярного взаимодействия. Тепловое движение атомов и молекул нарушает эту упорядоченную структуру. При каждом сочетании давления и температуры реализуется тот тип укладки частиц, который в данных случаях наиболее устойчив и энергетически выгоден, т. е. то или иное фазовое состояние.
Превращения кристаллов одного и того же вещества с различным типом решетки друг с другом происходят в соответствии с фазовыми переходами типа плавления и испарения. Каждому давлению соответствует определённая температура, при которой оба типа кристаллов сосуществуют. При изменении этих условий происходит фазовый переход. Хорошим примером данного явления является углерод. В природе встречаются три аллотропические модификации углерода: алмаз, графит и карбин.
Алмаз кристаллическое вещество с атомной кристаллической решеткой. Каждый атом в кристалле алмаза связан атомами. Это обусловливает исключительную твердость алмаза. Алмаз широко применяют для обработки особо твердых материалов: для резки стекла, при буровых работах, для вытягивания проволоки и др. Алмаз практически не проводит электрический ток, плохо проводит тепло. Прозрачные образцы алмаза сильно преломляют лучи света и при огранке красиво блестят, из таких алмазов делают украшения (бриллианты).
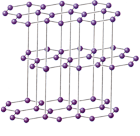
Графит непрозрачен, серого цвета, обладает металлическим блеском. В кристаллической решетке графита атомы углерода расположены слоями, состоящими из шестичленных колец. В них каждый атом углерода связан прочными ковалентными связями с тремя соседними атомами. За счет четвертого валентного электрона каждого слоя возникает металлическая связь. Этим объясняется металлический блеск и довольно хорошая электрическая проводимость и теплопроводность графита. Из графита изготовляют электроды для электрохимических и электрометаллургических процессов.
Между слоями в графите действуют межмолекулярные силы. Поэтому графит легко расслаивается на чешуйки. При слабом трении графита о бумагу на ней остается серый след (“графит” от латинского “пишущий”). Графит применяют для изготовления грифелей карандашей, в технике в качестве смазочного материала.
Графит тугоплавок, химически весьма устойчив. Из смеси графита с глиной изготовляют, огнеупорные тигли для выплавки металлов в металлургии. Графит применяют как материал для труб теплообменников в химической промышленности. В ядерных реакторах его используют в качестве замедлителя нейтронов.
Карбин стал известен сравнительно недавно. Он был получен советскими учеными, а уже позднее обнаружен в природе. Это черный порошок. Кристаллическая решетка построена из линейных углеродных цепочек. По электрической проводимости карбин занимает промежуточное положение между алмазом (диэлектрик) и графитом (проводник): карбин - полупроводник.
Аллотропические модификации углерода взаимопревращаемы. При нагревании алмаз постепенно переходит в графит. Для превращения графита в алмаз требуются очень высокое давление (порядка МО" Па) и высокая температура (1500-3000 °С). В настоящее время искусственное получение алмазов из графита проводится в производственных масштабах.
Поможем написать любую работу на аналогичную тему
Реферат
Типы кристаллических решеток. Свойства кристаллов: анизотропия, полиморфизм, монокристаллы и поликристаллы.
От 250 руб
Контрольная работа
Типы кристаллических решеток. Свойства кристаллов: анизотропия, полиморфизм, монокристаллы и поликристаллы.
От 250 руб
Курсовая работа
Типы кристаллических решеток. Свойства кристаллов: анизотропия, полиморфизм, монокристаллы и поликристаллы.
От 700 руб

