При нагревании оксида азота (IV) в закрытом сосуде до конкретной температуры, равновесия реакции 2NO2 = 2NO+O2 установилось при следующих условиях: =0,06 моль/л, =0,24 моль/л; =0,12 моль/л. Вычислите константу равновесия при этой температуре и исходную концентрацию NO2.
Решение
Константу равновесия данной реакции рассчитывают, исходя из равновесных концентраций исходных и конечных веществ в соответствии с законом действия масс:
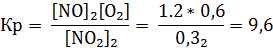
Поскольку к моменту установления равновесия в указанной системе образуется 1,2 моль NO, а по стехиометрии реакции из 2 моль NO2 образуется 2 моль NO, то количество израсходованного к этому времени оксида азота (IV) также составит 1,2 моль, что видно из следующей пропорции:
2 моль NO2 – 2 моль NO
Х моль NO2 – 1,2 моль NO
Х = 1,2 моль, т. е. израсходованная концентрация
|
с(NO2)изр |
= 1.2моль/л; |
Х= 1.2 моль, т. е израсходованная концентрация с(NO2)изр = 1.2 моль/л.
Израсходованная концентрация NO2 состоит : с(NO2)исх = + c( NO2)изр = 0,3+1,2 = 1,5 моль/л.
Ответ: Кс = 9.6; с(NO2)исх = 1,5 моль/л.
Поможем написать любую работу на аналогичную тему

