Клетки, выделенные из мышиных эмбрионов на стадии бластоцисты, могут пролиферировать в культуре, сохраняя способность к дифференцировке в любые типы клеток, в том числе и в клетки зародышевой линии, при введении в другой эмбрион на стадии бластоцисты. Такие клетки называются плюрипотентными эмбриональными стволовыми клетками (ЕS). ЕS-клетки в культуре легко модифицировать методами генной инженерии без нарушения их плюрипотентности. Например, в определенный сайт несущественного гена в их геноме можно встроить функциональный трансген. Затем можно отобрать измененные клетки, культивировать их и использовать для получения трансгенных животных (рис. 4). Это позволяет избежать случайного встраивания, характерного для метода микроинъекций и ретровирусных векторных систем.
Рекомбинантные гены вводят в такие клетки любым из вышеупомянутых способов, электропорацией или другими стандартными методами, применяемыми для доставки генов в культивируемые соматические клетки. При этом вместе с исследуемыми генами возможно введение селектируемых маркеров, которые позволяют проводить отбор клеток, экспрессирующих данные маркеры и, следовательно, гарантированно содержащих сцепленные с ними исследуемые гены.
При трансфекиии ЕS-клеток в культуре вектором, предназначенным для интеграции в специфический хромосомный сайт, в некоторых клетках ДНК встраивается случайным образом, в других встраивание происходит в нужный сайт, в большинстве же ЕS-клеток интеграции вообще не происходит. Для увеличения числа клеток первого типа используют позитивно-негативную селекцию. Эта стратегия состоит в позитивной селекции клеток, несущих векторную ДНК, встроившуюся в нужный сайт, и негативной селекции клеток с векторной ДНК, интегрировавшей в случайный сайт.
Сайт-мишень должен находиться в такой области геномной ДНК, которая не кодирует важных белков, чтобы интеграция чужеродной ДНК не повлияла на процессы развития или клеточные функции. Хоть этот метод не застрахован от ошибок, он позволяет обогатить клеточную популяцию клетками, несущими трансген в специфичном хромосомном сайте.
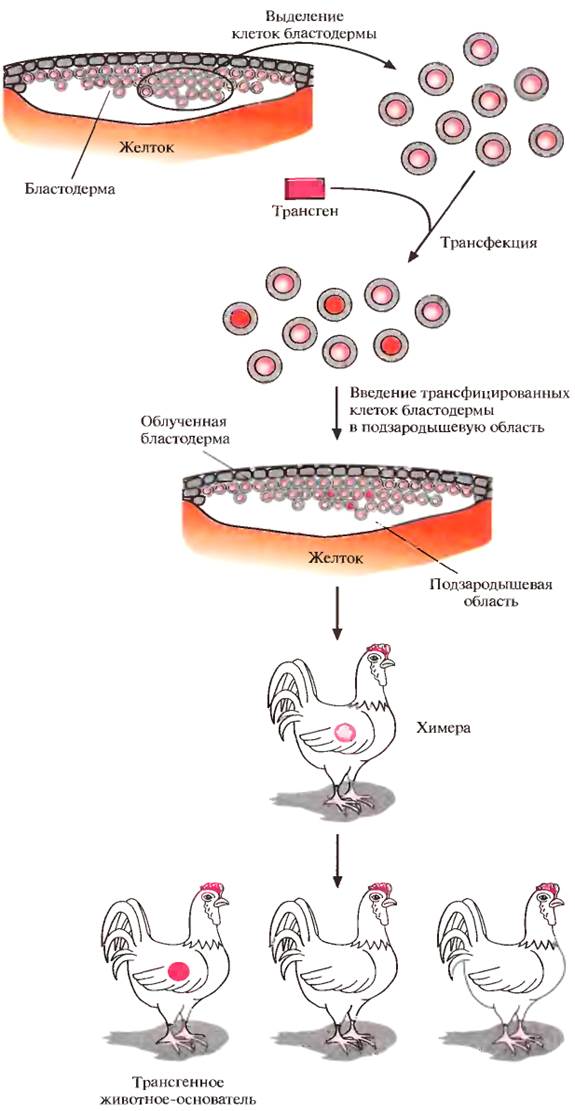
Рис. 4. Получение трансгенных мышей с помощью генетической модификации эмбриональных стволовых клеток.
Электропорация
Этот метод основан на способности клеточной мембраны, становиться проницаемой для экзогенных молекул ДНК под действием импульсов высокого напряжения. Когда различия в потенциалах на внешней и внутренней поверхности мембраны превысят определенный уровень, формируются временные поры, через которые способны проходить экзогенные молекулы. Изменение количества пор в мембране обратимо при условии, что величина или продолжительность импульсов высокого напряжения не превысит критического предела. Размер пор зависит от длины импульсов, силы электрического поля, а также ионного состава среды (рис. 5). Недостатком использования электропорации является постепенная деградация и уменьшение экспрессии трансгена со временем.
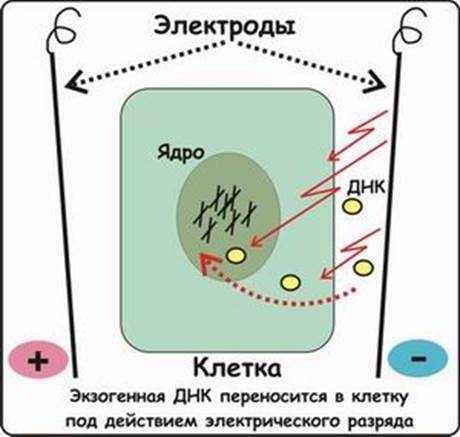
Рис. 5 Электропорация.
Биобаллистическая трансформация
Суть метода биобаллистической трансформации заключается в том, что на мельчайшие частички вольфрама, платины или золота, диаметром от 0,1 до 3,5 мкм, напыляется векторная ДНК, содержащая необходимую для трансформации генную конструкцию. Вольфрамовые, платиновые или золотые частички, несущие ДНК, на целлофановой подложке помещаются внутрь биобаллистической пушки. Суспензия животных клеток или эмбрионов, на ранней стадии развития, помещается под биобаллистическую пушку на расстоянии 10-25 см. В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления частички металла с огромной скоростью выбрасываются из пушки и, пробивая мембраны, входят в цитоплазму и ядра клеток. Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления частичек металла, в то время как в зоне 0,6-1 см от центра будут находиться трансформированные клетки (Рис.6). Далее клетки или эмбрионы животных переносят на среду для дальнейшего культивирования и регенерации.
Процент выживших клеток после бомбардировки составляет приблизительно 70%. Главным преимуществом данного метода является высокая эффективность встройки векторной ДНК, а также то, что можно получить трансгенные клетки в самые кратчайшие сроки. Недостатком этого метода является то, что эмбрионы, подвергшиеся бомбардировке, редко развиваются в полноценных взрослых особей, большая часть из них рано или поздно гибнет.
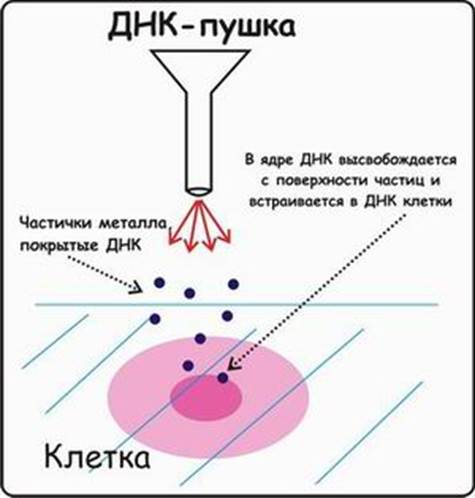
Рис. 6. Биобаллистическая трансформация.
Липофекция
Липосомы - это сферические образования, оболочки которых состоят из фосфолипидов. Их можно получить в результате резкого встряхивания или обработки ультразвуком водных эмульсий фосфолипидов.
Метод липофекции основан на взаимодействии между положительно заряженными молекулами фосфолипидов, из которых состоят липосомы, и отрицательно заряженными молекулами ДНК. В настоящее время предложены три модели ассоциаций между ДНК и фосфолипидами. Суть первой модели состоит в том, что положительно заряженные липосомы присоединяются к отрицательно заряженным молекулам ДНК. Число липосом, присоединившихся к ДНК, зависит от размеров молекулы нуклеиновой кислоты. Во втором случае молекулы ДНК "проглатываются" липосомами, то есть ДНК электростатически взаимодействует с внутренней поверхностью липосомы (рис. 7). В третьем случае молекула ДНК окружена несколькими молекулами фосфолипидов, которые формируют своеобразную ленту с нуклеиновой кислотой.
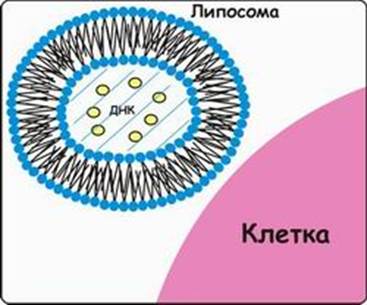
Рис. 7. Липофекция (2-я модель).
Липосомы, несущие положительный заряд, легко присоединяются к несущей отрицательный заряд плазматической мембране животных клеток, после чего путем эндоцитоза проникают в цитоплазму клеток. Механизмы же, обеспечивающие встраивание в геном и экспрессию ДНК, не достаточно изучены.
К преимуществам данного метода можно отнести низкую токсичность липосом по отношению к клеткам, а также то, что экзогенный генетический материал защищен от действия нуклеаз посредством транспортировки в липосомах. Недостатком данного метода является то, что количество личинок, экспрессирующих трансген сокращается с возрастом.
. Клонирование с помощью переноса ядра
Плюрипотентность можно выявить, если перенести ядро тестируемой клетки в яйцеклетку с удаленным ядром и затем исследовать способность последней к развитию и образованию жизнеспособного потомства. Ядра эмбриональных клеток способны - хотя и с низкой эффективностью — обеспечивать развитие. Например, с помощью переноса ядер эмбриональных клеток КРС, культивированных непродолжительное время, были получены жизнеспособные особи. Известная овца по имени Долли была клонирована с помощью переноса ядра клетки молочной железы (вымени) взрослого животного (рис. 8). Возможно, донорское ядро было взято из недифференцированной клетки, присутствовавшей в эпителии молочной железы организма-донора.
Клонирование Долли из ядра дифференцированной клетки и трех других овец из ядер эмбриональных клеток удалось осуществить благодаря переносу ядер из клеток, находящихся в стадии покоя (G0), и, возможно, особенностям эмбриогенеза этого животного. Дело в том, что в течение первых трех делений зиготы овцы, занимающих несколько суток, происходит только репликация ДНК, ни один из генов не экспрессируется. Предполагается, что за это время введенная ДНК освобождается от специфичных для клетки регуляторных белков, а соответствующие гены эмбрионального развития связываются с инициаторными эмбриональными белковыми факторами из цитоплазмы яйцеклетки.
Основная проблема, которую нужно решить, — это сохранение плюрипотентности клеток в непрерывной культуре. Однако вследствие видовых различий во времени процесса деления клетки на ранних стадиях эмбриогенеза и инициации транскрипции в этот период пока не ясно, удастся ли осуществить перенос ядра в случае каких-либо других животных, кроме овец, если донорское ядро будет находится на той же стадии, что и яйцеклетка.
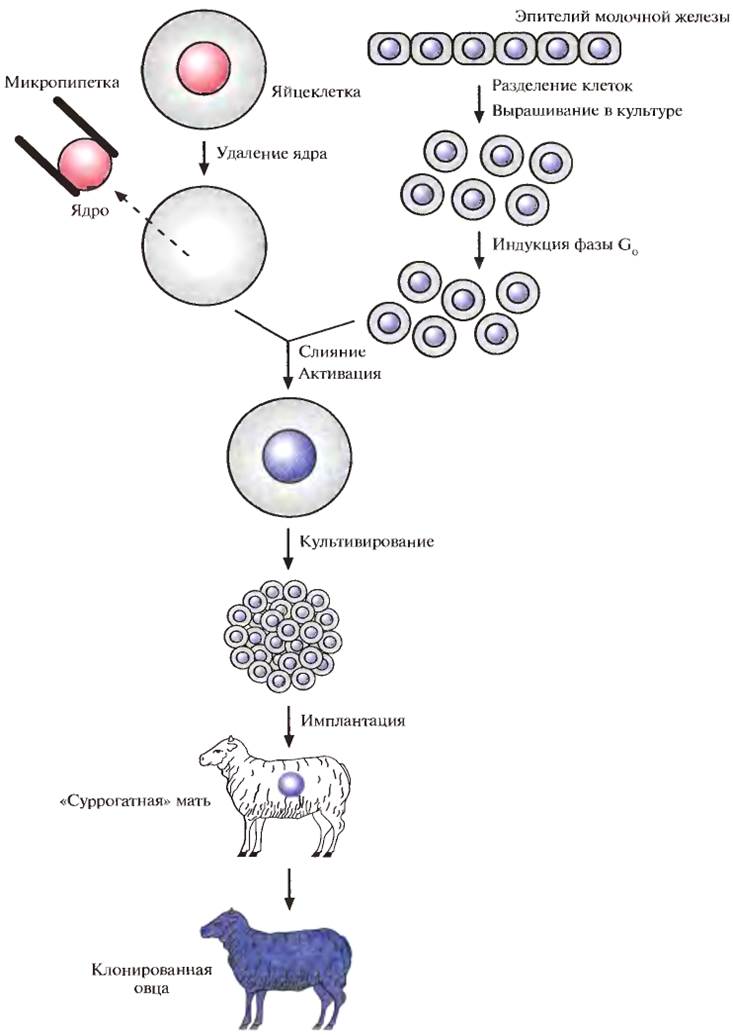
Рис. 8. Клонирование овцы методом переноса ядра. Ядро яйцеклетки удаляют с помощью микропипетки. Культивируют эпителиальные клетки молочной железы взрослой особи и индуцируют их переход в фазу Gо. Осуществляют слияние клетки в Go-фазе и яйцеклеток, лишенных ядра, и выращивают восстановленные яйцеклетки в культуре или в яйцеводе с наложенной лигатурой до ранних стадий эмбриогенеза, а затем имплантируют их в матку «суррогатной» матери, где и происходит дальнейшее развитие.
Перенос генов с помощью искусственных дрожжевых хромосом
Хромосомы высших организмов содержат в своем составе протяженные молекулы ДНК. Исследование генов в хромосомах высших растений, животных и человека потребовало создания векторов для клонирования фрагментов ДНК длиной в несколько сотен тысяч пар оснований. Этим задачам отвечает система для клонирования сверхдлинных молекул ДНК на основе искусственно полученной мини-хромосомы дрожжей YAC (yeast artificial chromosome). YAC-вектор представляет собой кольцевую молекулу ДНК, содержащую ряд генетических элементов, которые позволяют ей существовать во внехромосомном состоянии в клетках дрожжей (рис. 9).
Вектор заключает в себе две теломерные последовательности нуклеотидов TEL, необходимые для репликации концов мини-хромосомы, и область начала репликации ARS1, соединенную с последовательностью центромеры. Все эти функциональные элементы требуются для репликации YAC-вектора и его правильной передачи в дочерние ядра во время митоза. Кроме того, вектор содержит два селектируемых маркера TRP, восстанавливающих способность к росту ауксотрофных по триптофану клеток дрожжей в отсутствие экзогенного триптофана, а также маркер URA3, компенсирующий генетический дефект клеток дрожжей, который нарушает биосинтез урацила. В векторе имеется также ген супрессорной тРНК sup4, являющийся селектируемым маркером для поддержания вектора в мутантных бактериальных клетках, содержащих амбер-мутации в жизненно важных генах. Помимо этого, он обладает последовательностями нуклеотидов, необходимыми для его репликации в бактериальных клетках.
При подготовке к клонированию YAC-вектор, выделенный в виде плазмиды, расщепляют рестриктазой BamHI и отделяют от образовавшегося короткого фрагмента ДНК, который не требуется для репликации YAC-вектора в дрожжах (этап 1). После этого проводят второе расщепление вектора рестриктазой EcoRI, сопровождающееся образованием двух его "плеч", каждое из которых на одном из концов содержит теломерные последовательности хромосомы дрожжей (этап 2). На заключительном этапе (3) полученные "плечи" лигируют с крупными EcoRI-фрагментами клонируемой ДНК, которые получают путем частичного расщепления высокомолекулярной хромосомной ДНК, предназначенной для клонирования. Полученными таким образом рекомбинантными ДНК трансформируют протопласты клеток дрожжей, и образовавшиеся трансформанты отбирают на селективной твердой питательной среде.
При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов.
Создание мышей, которые синтезировали бы только человеческие антитела, — это примечательный пример трансгеноза с помощью YАС. Моноклональные антитела можно использовать для лечения некоторых заболеваний человека. Однако получить человеческие моноклональные антитела практически невозможно. К сожалению, и моноклональные антитела грызунов иммуногенны для человека. Чтобы «очеловечить» существующие моноклональные антитела грызунов, были разработаны сложные стратегии с использованием рекомбинантных ДНК. В результате этих трудоемких процедур удалось получить Fv- и Fab-фрагменты, зачастую обладающие каким-то сродством к специфическому антигену. Возможно, технологического прорыва удастся достичь, если использовать для получения полноразмерных человеческих антител более доступный метод с использованием гибридом.
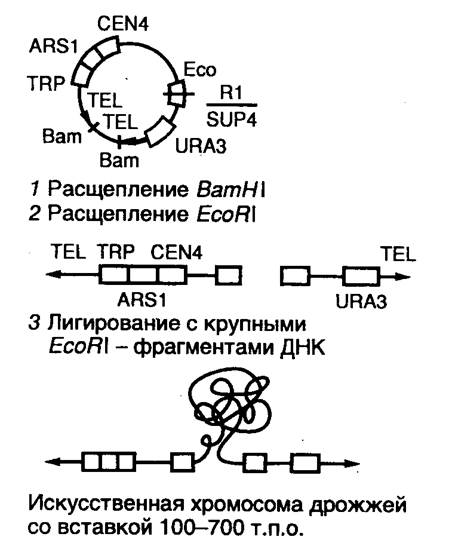
Рис. 9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC
1 – линеаризация ДНК вектора рестриктазой BamHI;
2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием "плечей";
3 – введение в вектор клонируемого EcoRI-фрагмента ДНК
Поможем написать любую работу на аналогичную тему

