Удивительная стабильность генетического материала – ДНК связана отнюдь не с ее консервативностью, а с существованием в клетках всех живых организмов специальных систем репараций, устраняющих из ДНК возникающие в ней повреждения.
Явление репарации, или восстановление жизнеспособности клетки, после действия на нее γ- и рентгеновых лучей было открыто в 1958 г. В. И. Корогодиным у диплоидных дрожжей. Повреждения ДНК, возникающие при действии излучений и химических агентов, в конечном счете приводят к нарушению регулярной Уотсон – Криковской структуры, что выражается в локальной денатурации молекулы и приводят к частичному или полному блокированию репликации. Именно такие нарушения конформации, а не конкретные изменения мономеров служат мишенью для большинства систем репарации ДНК.
В настоящее время известны следующие типы систем репарации:
1) Химическая – восстанавливает химическую структуру модифицированных нуклеотидов.
2) Фотореактивация – восстановление ДНК, поврежденных УФ – излучением, под действием видимого света.
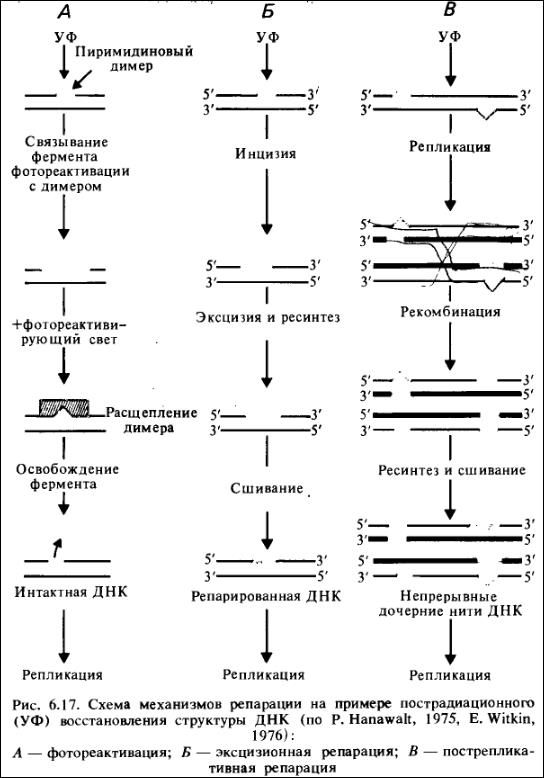
3) Эксцизионная – вырезание поврежденного участка ДНК и восстановление исходной структуры цепи (режь – латай)
4) Пострепликативная:
a) Рекомбинантная пострепликативная репарация после репликации поврежденной ДНК.
b) SOS – репарация – пострепликативная репарация склонная к ошибкам.
Фотореактивация
Явление фотореактивации заключается в восстановлении биологической активности клеток или молекул ДНК, поврежденных ультрафиолетовым излучением в результате последующего воздействия видимого света.
При фотореактивации происходит мономеризация циклобутановых димеров тимина и других пиримидиновых димеров in situ. Известна так называемая не ферментативная коротковолновая фотореактивация, которая заключается в мономеризации димеров при действии ультрафиолетового света с длиной волны 240 нм, а также ферментативная фотореактивация. Именно последнюю обычно и подразумевают под собственно фотореактивацией.
Фотореактивация при действии видимого света (300—400 нм — наиболее активная часть спектра) была обнаружена в 1949 г. в нескольких лабораториях. Механизм этого явления был раскрыт в начале 60-х годов нашего века после выделения К. Рупертом из клеток микроорганизмов фермента фотореактивации — дезоксирибопиримидинфотолиазы. Экстракты дрожжей оказались способными восстанавливать трансформирующую активность ДНК Haemophyllus influenzae на свету.
Субстратом фермента фотореактивации служат димеры пиримидиновых оснований, с которыми он образует комплекс в темноте (с неповрежденной ДНК фермент не связывается). На свету комплекс распадается, при этом происходит мономеризация димеров. В клетке эукариот фермент локализован в ядре, у прокариот — в непосредственной близости к нуклеоиду. В частности, он не обнаруживается в безнуклеоидных миниклетках, которые образуют некоторые мутанты Е. coli.
Известен мутант phr Е. coli, у которого блокирована фотореактивация. При облучении видимым светом у этого мутанта не исчезают тиминовые димеры из ДНК.
Фермент фотореактивации широко распространен в природе и обнаружен даже у таких примитивных свободноживущих микроорганизмов, как микоплазмы, найден он в клетках многих высших растений и животных. Он есть у всех изученных бактерий, за исключением Micrococcus radiodurans, который тем не менее чрезвычайно устойчив к действию ультрафиолетового света: он выдерживает дозы, в 1000 раз более высокие, чем те, которые убивают Е. coli. При полном отсутствии способности к фотореактивации М. radiodurans обладает мощной системой эксцизионной репарации.
Эксцизионная репарация
Эксцизионную репарацию, т. е. связанную с удалением поврежденного участка ДНК, называют также репарацией по типу выщепления — замещения или более образно «механизм режь — латай» (рис. 6.17). Эксцизионная репарация не столь специфична в отношении повреждений ДНК, как фотореактивация, тем не менее наиболее подробно изучена именно репарация ДНК, содержащей тиминовые димеры. Этому способствовало то обстоятельство, что возможность фотореактивации клеток — критерий присутствия тиминовых димеров в ДНК. Появление димеров приводит к локальной денатурации ДНК, что влечет за собой нарушение процесса репликации: каждый тиминовый димер в ДНК Е. coli задерживает репликацию на 10 с.
Доказательство существования и изучение механизма эксцизионной репарации стало возможным благодаря получению мутантов Е. coli, чувствительных к летальному действию ультрафиолетового света. Если штаммы Е. coli, устойчивые к ультрафиолетовому свету, инкубировать в темноте после облучения, то из их ДНК удаляются тиминовые димеры. У мутантов, чувствительных к ультрафиолетовому свету, этого не происходит.
Эксцизионная репарация представляет собой многоэтапный процесс и заключается в: 1) «узнавании» димера, 2) надрезании одной цепи ДНК вблизи димера — инцизии, 3) удалении димера — эксцизии, 4) ресинтезе ДНК и 5) восстановлении непрерывности репарируемой цепи за счет образования ковалентных связей сахарофосфатного скелета молекулы.
«Узнавание» повреждения в ДНК осуществляет фермент УФ- эндонуклеаза, который реагирует не только на димеры тимина, но и на многие другие изменения, приводящие к локальному ftapyшению структуры ДНК. Эндонуклеаза ответственна и за инцизию, т. е. надрезание одной цепи ДНК (разрыв фосфодиэфирных связей) непосредственно около димера с 5'-конца в поврежденной цепи. Эксперименты in vitro с облученной ДНК показали, что число однонитевых разрывов оказывается равным числу димеров в молекуле.
Эксцизию, или вырезание димера из молекулы ДНК, осуществляет другая нуклеаза. Димер удаляется в составе короткого олигонуклеотида (3—5 оснований), что может сопровождаться дальнейшей деградацией поврежденной спирали. Продукты деградации облученной ДНК, содержащие тиминовые димеры, можно обнаружить в клетках. У некоторых бактерий димеры находили и в культуральной среде. Деградацию ДНК осуществляет АТФ- зависимая ДНКаза. В результате эксцизии и последующей деградации ДНК образуются однонитевые бреши, или пробелы. ,
Ресинтез ДНК, в результате которого заполняются бреши, идет с использованием в качестве матрицы интактной цепи. Такой репаративный синтез ДНК напоминает «дополнительную» репликацию, обнаруженную в пахитене у эукариот. Прямое доказательство репаративного синтеза у бактерий получили Д. Петтиджон и Ф. Хэнэуолт, использовавшие для этой цели метод М. Мезель- сона и Ф. Сталя (рис. 6.18).
ДНК Е. coli метили 14С, выращивая клетки в присутствии радиоактивного тимина, а затем изучали репликацию в присутствии 5-бромурацила, меченного 3Н. В результате нормальной репликации (рис. 6.18, А) при центрифугировании в градиенте плотности можно наблюдать смещение пика распределения молекул: при этом бромурацил играет роль плотностной метки. В соответствии с этим гибридные молекулы ДНК оказываются меченными 14С и 3Н. При изучении тем же методом ДНК, выделенной из облученных клеток, обнаруживали только один пик, соответствующий по плотности исходным молекулам. Тем не менее эти молекулы содержали как |4С, так и небольшое количество 3Н (рис. 6.18, Б).
Этот пик радиоактивности появлялся вследствие включения 5-бромурацила в ДНК в ходе репаративного синтеза. Однако фрагменты ДНК, содержащие 5-бромурацил, столь невелики (в среднем пять нуклеотидов на один димер), что не влияют на плавучую плотность молекул, извлекаемых из клетки. Подтверждением предложенного объяснения наблюдаемой картины служило, во-первых, то, что фотореактивация снимала ресинтез ДНК: исчезал дополнительный пик радиоактивности 3Н; во-вторых, репаративный синтез не отмечался у мутантов, не способных выщеп- лять димеры тимина. Механизм синтеза ДНК, наблюдаемый в ходе репарации после ультрафиолетового облучения, получил наименование неполуконсервативного.
Основной фермент, ответственный за эксцизию димеров и репаративный синтез ДНК, — это ДНК-полимераза I, кодируемая геном pol А. Тем не менее у мутантов pol А, дефектных по ДНК- полимеразе I, все же наблюдается остаточный репаративный синтез, который связан с активностью ДНК-полимеразы II.
Известно, что неполуконсервативный синтез ДНК в 99% случаев происходит на коротких участках длиной до 30 нуклеотидов. За эту реакцию ответственна ДНК-полимераза I. В 1 % случаев синтез идет на гораздо более длинных отрезках — 1000—1500 нук-
леотидов. По-видимому, эту реакцию и осуществляет ДНК-полимераза II.
Последний этап эксцизионной репарации заключается в восстановлении непрерывности репарируемой цепи ДНК с помощью фермента ДНК-лигазы, кодируемого геном lig Е. coli. Тем- пературочувствительные мутанты по этому гену не способны не только завершать процесс эксцизионной репарации в непермис- сивных условиях, но и накапливают фрагменты Оказаки при репликации ДНК.
Различные варианты эксцизионной репарации широко распространены у про- и эукариотических организмов. Она обнаружена у простейших (например, Tetrachimena pyriformis), в культуре клеток млекопитающих. Удаление тиминовых димеров из клеток млекопитающих сопровождается так называемым внеплановым синтезом ДНК, который происходит по репаративному типу: вне S-фазы клеточного цикла. Он аналогичен пахитенному синтезу ДНК в мейозе. Внеплановый синтез ДНК показан в зародышевых клетках и на постмейотических стадиях гаметогенеза у самцов мыши после действия этилметансульфоната. В ходе эксцизионной репарации у млекопитающих включается в среднем 20 новых нуклеотидов на каждый тиминовый димер. Известна мутантная линия клеток китайского хомячка с ослабленным (по сравнению с исходной линией) внеплановым синтезом ДНК, проявляющая повышенную чувствительность к ультрафиолетовому свету.
Нарушения процессов репарации ДНК обнаружены у людей, пораженных наследственным заболеванием — пигментной ксеро- дермой. Известно несколько типов этой болезни: XPI, XPII, XPvar, общими симптомами которой служит повышенная чувствительность к солнечному свету, приводящая к развитию рака кожи. Культура клеток больных XPI чувствительна к ультрафиолетовому свету, но не к ионизирующим излучениям. У этих больных дефект эксцизионной репарации связан с отсутствием активности УФ- эндонуклеазы. В культуре клеток здоровых людей после облучения ультрафиолетовым светом в дозе 10 Дж/м2 через 20 ч из ДНК исчезает до 90% тиминовых димеров (со скоростью 40 000 димеров в час), в то время как в клетках больных XPI димеры вообще не удаляются из ДНК.
Тип XPII чувствителен как к ультрафиолетовому, так и к рентгеновскому излучениям. Клетки XPII не способны репарировать ДНК, имеющую однонитевые разрывы. По-видимому, это связано с отсутствием в них фермента, аналогичного ДНК-полимеразе I Е. coli. Наконец, в клетках больных третьего типа — XPvar выщепление димеров тимина идет нормально, а дефект связан с иным типом репарации — пострепликативной.
Пострепликативная репарация
Этот тип репарации был открыт в клетках мутантов Е. coli, не способных выщеплять тиминовые димеры. В таких клетках после ультрафиолетового облучения происходит репликация ДНК, хотя и медленнее, чем в клетках дикого типа. У. Рапп и П. Говард-Фландерс показали, что в клетках мутантов uvr А после действия ультрафиолетового света синтезируется ДНК с однонитевыми пробелами, или брешами, причем длина вновь синтезированных фрагментов соответствует среднему расстоянию между возникшими в родительской ДНК тиминовыми димерами. Таким образом, после репликации нерепарированной ДНК против тиминовых димеров образуются бреши, которые, как оказалось, исчезают при последующей инкубации клеток в питательной среде. Этот тип репарации не происходит в клетках гес-мутантов, дефектных по рекомбинации (см. гл. 7). Поэтому пострепликативную репарацию называют также рекомбинационной репарацией.
Механизм пострепликативной репарации наименее специфичен, так как здесь отсутствует этап узнавания повреждения. Представления об этом типе репарации связаны со знанием механизма рекомбинации (см. гл. 7). Рекомбинационная пострепликативная репарация — это быстрый способ восстановления нативной структуры по крайней мере части дочерних молекул ДНК. При этом тиминовые димеры остаются в исходных родительских нитях. Эта репарация происходит уже в первые минуты после облучения.
Существует и другая разновидность — медленная пострепликативная репарация, для осуществления которой требуется несколько часов. Ее проводит система ферментов, которых нет в необлученных клетках и которую индуцирует облучение. Этот механизм получил наименование SOS-репарации. Его характерная черта — неточность восстановления первичной структуры ДНК, в связи с чем он получил также название репарации, склонной к ошибкам. При этом, по мнению ряда авторов, возможен репаративный синтез ДНК «в обход» тиминовых димеров, или, точнее за счет использования в качестве матрицы цепи ДНК, содержа щей димеры.
Пострепликативная репарация существует не только у бактерий, но и в клетках эукариот. Она обнаружена и у млекопитающих, для которых получены данные о том, что пострепликативные бреши могут заполняться не за счет рекомбинации, а за счет синтеза ДНК de novo. Уже упоминалось о том, что один из типов пигментной ксеродермы у человека (ХРУаг) связан с блоком пострепликативной репарации.
Ограничимся рассмотрением репарации ДНК только на примере восстановления структуры молекул, облученных ультрафиолетовым светом. ДНК, поврежденная ионизирующим излучением, также может быть восстановлена системами репарации. При этом устраняются однонитевые и двунитевые разрывы. Многие этапы восстановления ДНК после действия ультрафиолетового света и ионизирующих излучений одинаковы, однако есть и существенные различия, как, например, при устранении двунитевых разрывов.
Поможем написать любую работу на аналогичную тему

