Принцип действия потенциометрических анализаторов, относящихся к электрохимическим средствам измерений, основан на измерении потенциала электрода, размещенного в электролите, по которому определяется концентрация определяемого компонента анализируемого вещества.
В силу того, что электродный потенциал непосредственно измерить нельзя, его измеряют косвенным путем по ЭДС гальванического элемента, составленного из измерительного (индикаторного) электрода и сравнительного (вспомогательного или опорного) электрода. Оба электрода погружены в исследуемый электролит, например, анализируемую жидкость, протекающую через ячейку. Потенциал измерительного электрода Еи изменяется при изменении концентрации ионов в анализируемой среде, а потенциал сравнительного электрода остается постоянным, так как он не зависит от концентрации ионов в анализируемой среде. ЭДС такого гальванического элемента Е определяется разностью потенциалов измерительного и сравнительного электродов: Е = Еи - Еср,
Где Е – ЭДС гальванического элемента, В; Еи – потенциал измерительного электрода, В; Еср – постоянный потенциал, В.
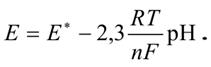
В потенциометрии при создании гальванических элементов и электродов используются следующие потенциалы: электродный, возникающий при погружении металлических электродов в раствор их ионов; мембранный, возникающий на мембранах, обладающих селективной проницаемостью для одного типа ионов (полупроницаемые мембраны) и разделяющих два одинаковых раствора, содержащих эти ионы в различных концентрациях; окислительно-восстановительный (редокс-потенциал), устанавливающийся на инертных металлических электродах, помещенных в раствор окислительно- восстановительных веществ; диффузионный, возникающий в месте контакта двух растворов одного и того же вещества, обладающих разной концентрацией, или между двумя растворами разных веществ.
рН – это кислотность среды ( 0 -14 ), меньше 7 кислотная , больше 7 щелочная.
Для определения величины pH существуют два основных метода:
1)колориметрический - основан на изменении окраски индикатора, добавленного к исследуемому раствору, в зависимости от величины pH.
2) потенциометрический - основан на измерении ЭДС электродной системы, состоящей из индикаторного электрода и электрода сравнения. Электрод сравнения иногда называют вспомогательным электродом.
При этом значения концентраций, измеряемых потенциометрическими
анализаторами, составляют 10-2—10-7 г-ион/л.
Поможем написать любую работу на аналогичную тему

