Все движения в нашем Мире имеют в основе квантовый характер, особенность которого состоит в непредсказуемости. Нельзя точно указать, когда произойдёт скачок из одного квантового состояния в другое, как, например, при распадах ядер атомов. Нельзя указать, через какое из двух отверстий в экране пролетела частица, след которой обнаружен на пластинке за экраном. Квантовые законы ограничивают возможность точно определить одновременно и положение и скорость движущейся частицы.
Как же тогда в нашем Мире, основанном на случайности, возможны строгая связь между причиной и следствием и существование точных законов? Ведь только благодаря точным законам природы удаётся создать работоспособные системы. Случайность в работе систем неизбежна, и это должно проявляться как их неконтролируемое поведение. В общем плане этот вопрос ставится так: как в природе могут сосуществовать определённость (детерминизм) и случайность.
Содержательный ответ на этот вопрос был получен в средние века в экономической и финансовой практике. В дальнейшем, развитие представлений о том, как из массы случайностей получается строгая закономерность, составило основу так называемого статистического принципа. Его суть можно выразить так: из хаоса единичных отношений (между людьми) складываются законы (общества), которые строго выполняются. Конечно, в финансово-экономических отношениях есть организующей фактор, связанный с сознанием элементов (людей), образующих систему (общество). У неживой природы сознание отсутствует. Но именно в неживой природе было выяснено с предельной достоверностью, как из случайности получается строгая закономерность. Излагаемое ниже можно рассматривать как возврат с громадными процентами заимствования естествознанием у экономической и финансовой практики статистического принципа.
Рассмотрим, что такое случайность и что такое закономерность. Обычно и то, и другое связывается с осуществлением событий. Если ход предшествующих событий в некоей последовательности даёт возможность предсказать дальнейшие события, то говорят о наличии закономерности. Например, в смене дня и ночи обнаруживается закономерность, причём и без знания её причины. Если в последовательности событий нет закономерности, то невозможно предвидеть исход будущих событий. Так, при бросании двух одинаковых игральных кубиков может получиться серия совпадений, но это не значит, что и дальше бросания дадут одинаковый результат.
Причина, по которой возможны закономерности в последовательности событий, представляется понятной. Это – наличие связи между причиной, вызывающей событие, и следствием – характеристикой события – в ходе последовательности событий.
Менее понятна природа случайности. Считается, что случайность появляется вследствие нашей неосведомлённости. Но не только в смысле незнания природы событий, а из-за недостаточности сведений о характеристиках событий или ограниченности возможности реализации программы предсказания события. Так, например, считается, что, если задать параметры движения игрального кубика в момент броска, то законы механики позволят предсказать достоверно его результат. Но, чтобы получить этот результат, необходимо задавать исходные параметры чрезвычайно точно и затем произвести громадный объем расчетов дальнейшего движения.
Каким образом и почему возникают и утрачиваются связи, которые регламентируют ход событий в их последовательности, – вопрос, который не рассматривается в рамках статистического принципа. Речь будет идти о законах, которые действуют в мире действительно случайных событий.
На примере идеального игрального кубика можно пояснить, о какого рода законах может идти речь. Когда невозможно предвидеть результат очередного броска, можно утверждать, что в длинной серии бросков число 1 будет встречаться так же часто, как и 6. Более того, можно сказать, насколько будут различны ожидаемые числа появлений 1 и 6 в зависимости от длины серии, но при полной неопределённости того, что появится чаще.
С понятием случайности тесно связано понятие порядка и беспорядка. Вообще говоря, порядок - понятие условное. Так, например, последовательность 0123456789 кажется более упорядоченной, чем 7549602381. Однако если с последним рядом связана некая информация, например, шифр сейфа, то именно такую последовательность следует считать упорядоченной. Так что основное свойство упорядоченных событий связано с их выделенностью по определённому признаку на фоне всех остальных возможных последовательностей событий.
Такое понимание порядка и беспорядка позволяет объяснить бытовое явление, почему так легко возникает беспорядок и так непрочен порядок. Просто в ситуациях, когда имеются последовательности событий или много предметов, они могут находиться как в выделенной форме (все элементы находятся на своих местах), так и в других возможных видах. При этом обычно упорядоченных расположений немного, а всех возможных – много.
Насколько беспорядочные расположения преобладают при увеличении числа предметов, показывает простой расчет числа возможных размещений книг 10-томной серии. Это число – число всех перестановок, и оно равно 10! = 3628800, т.е. больше трёх миллионов. Если на каждую перестановку затратить 1 секунду, то потребуется 42 суток на то, чтобы перебрать все возможности. Так что, если придётся расставлять тома не глядя, то нет практически никакого шанса расположить их в правильном порядке.
Естественно охарактеризовать такое свойство системы, как количество возможного в ней беспорядка, числом состояний, в которых может эта система находиться. Более удобной характеристикой “беспорядочности” системы оказалось не само число состояний, а его логарифм. Удобство этой характеристики связано с тем, что она позволяет предписать “закон сложения беспорядков” для составных систем. Так, если в одной системе возможно N1 состояний, а в другой N2, то в составной системе число состояний будет
N = N1N2 , и lnN = lnN1+lnN2.
Логарифм числа возможных состояний имеет специальное название энтропия (превращение) и играет важную, если не главную роль в описании статистических закономерностей в природе.
В рассмотренном выше примере энтропия системы S из 10 томов будет равна ![]() . В дальнейшем будет идти речь о логарифмах больших значений факториала. Они приближённо выражаются формулой ln(N!)≈ N(lnN
- 1). Для рассмотренного случая N = 10 эта формула даёт значение
S ≈ 10(ln10 – 1) ≈ 13. Здесь относительная точность невелика ~14%. Но, чем больше N, тем выше относительная точность данной формулы.
. В дальнейшем будет идти речь о логарифмах больших значений факториала. Они приближённо выражаются формулой ln(N!)≈ N(lnN
- 1). Для рассмотренного случая N = 10 эта формула даёт значение
S ≈ 10(ln10 – 1) ≈ 13. Здесь относительная точность невелика ~14%. Но, чем больше N, тем выше относительная точность данной формулы.
Рассмотрим, как с помощью понятия энтропии выясняется, что будет при соединении двух систем, между которыми возможен обмен элементами, например, в следующей ситуации. Пусть две одинаковые комнаты с разным числом людей в каждой разделены дверью. После открытия двери люди из одной комнаты получают возможность находиться в другой. Пусть сначала в одной комнате было n1 человек, а в другой - n2
и вместе n = n1 + n2. В дальнейшем возможны разные распределения числа людей: так, если одной комнате находится k
человек, то в другой: n – k. Будем характеризовать каждый случай числом людей в одной из комнат. Поскольку число людей в комнате может меняться от 0 до n , то число разных случаев будет (n + 1); при этом k меняется от 0 до n. Здесь каждый случай получается разным числом людей. Очевидно, что случай, когда все находятся в одной комнате (как и когда в ней нет никого) получается единственным способом. Если в комнате есть только один человек, то этот случай может быть реализован n
способами. В общем случае, когда в комнате находится k человек, число его реализаций равно ![]() .
.
Поскольку каждому списку людей в одной комнате соответствует единственный состав оказавшихся в другом списке,– перечисление всех случаев для одной комнаты полностью характеризуют состояние в обеих комнатах.
Теперь предположим, что среди всех случаев будут преобладать те, которые получаются наибольшим числом способов, иными словами, более беспорядочные случаи. Это значит, что у этих случаев наибольшая энтропия. Для этого вычислим максимум величины
![]()
считая n постоянной, а k непрерывной переменной величиной. Пользуясь приближённым выражением для логарифма факториала и вычисляя производную от него, получим уравнение для значения k* , при котором энтропия максимальна: ln(k*) = ln(n - k*). Из решения последнего следует, что k* = n/2 и преобладающим является случай равного числа людей в двух комнатах.
Таким образом, интуитивно ожидаемый результат следует, как оказалось, из свойства системы пребывать в состоянии с наибольшим беспорядком. Рассмотрим, как из этого свойства определится распределение людей в двух неодинаковых комнатах: большой и маленькой. Для такой ситуации, кроме общего числа людей n, следует задать число мест (например, стульев) в каждой комнате. Пусть будет m1 стульев в одной комнате и m2 в другой. Естественно принять, что m1 + m2 = m > n , и пусть все величины намного больше единицы.
Теперь, когда в первой комнате k и в другой (n - k) людей, разными будут считаться случаи их разного расположения по местам, причём эти расположения не зависимы друг от друга. Число таких разных расположений равно:
N1 = (k + m1 – 1)!/k!(m1 – 1)! – для первой комнаты и
N2 = (n – k + m2 – 1)!/(n – k)!(m2 – 1)! – для второй.
Энтропия рассматриваемой системы определяется суммой S = lnN1 + lnN2.
Как и раньше, предполагается, что состояния, в которых преимущественно находится система, имеют максимальный беспорядок и максимальное значение энтропии. Определяя максимум энтропии подобно сделанному выше, в результате получим соотношение, определяющее величину k*: k*/m1 = (n – k*)/m2. Из этого соотношения можно просто найти k*, но из данной формулы яснее виден результат, который можно выразить так: наибольший беспорядок и соответствующее ему преимущественное состояние системы будет, когда концентрация, или доля занятых мест в комнатах одинаковая.
Этот результат полностью соответствует такому наблюдаемому явлению. Если соединить две любых емкости с газом, то всегда получится в итоге состояние с везде одинаковой концентрацией. Вне зависимости от причины, которая вызывает перетекание газа и деталей процесса, конечным оказывается результат, который следует только из свойства систем приходить в состояния с максимальной энтропией, или наибольшего беспорядка.
Таким образом объясняются многие наблюдаемые необратимые явления, и их характер определяет т.н. второй закон термодинамики, называемый ещё принципом возрастания энтропии. Этот закон формулируется так: энтропия системы из большого числа элементов, не подверженная внешнему действию, остаётся постоянной или возрастает. В частности, при объединении двух систем изменения в них идут в направлении увеличения общего беспорядка. Состояние с максимальной энтропией называют состоянием термодинамического равновесия.
Этот вывод иллюстрирует специфику статистических принципов, из которых получаются закономерности на основе абсолютного игнорирования связей следствия с причиной. В определённой степени к этому принципу близка идея либеральной рыночной экономики, в которой считается, что устойчивое состояние в сложных системах достигается самопроизвольно. И это состояние соответствует максимуму возможностей при, разумеется, оговоренных ограничениях.
Следующий вывод из статистического принципа связан с природой необратимости самопроизвольных процессов. Речь идёт о возможности прихода системы в начальное состояние после того, как она ушла из него в состояние с максимальной энтропией. В частности, возможно ли самопроизвольное возвращение газа в ту половину сосуда, в которой он был до расширения в пустовавшую часть?
Ответ на вопросы такого рода следующий. В состоянии максимального беспорядка совершенно утрачена связь с прошлым, система как бы “забыла” то состояние, из которого стартовала. Поэтому начальное состояние может получиться из равновесного только случайно. Поскольку начальное состояние единственное, оно может появиться повторно тем реже, чем больше общее число всех возможных состояний. В примере с 10-ю томами это означает, что при случайных перестановках книг начальное расположение может образоваться как одно из числа более трёх миллионов. Или, другими словами, оно будет существовать в течение 1 секунды за период в 42 дня. При большом числе элементов в системе частота появления выделенного (начального) состояния может стать практически ненаблюдаемой.
Хотя системы находятся преимущественно в состоянии с максимальной энтропией, это не значит, что они находятся только в таком состоянии. Из рассмотренных примеров с двумя комнатами вытекает, что в первом примере не всегда будет точно половина людей в комнатах, а во втором примере плотность людей в разных комнатах будет временами различаться. Такие отклонения от преимущественных состояний, называемые флуктуациями, могут стать заметными только при ряде условий. Так, очевидно, что очень большие отклонения будут редкими и поэтому возможно не обнаружимыми. Интересно выяснить, при каких условиях флуктуации обнаруживаются.
Узнать это удобнее с помощью понятия вероятность события, которое определим здесь как отношение числа интересующих нас событий к числу всех возможных событий. Поскольку последнее число величина постоянная, характеризующая систему, а не её изменяемые состояния, – можно определение энтропии видоизменить так:
S = lnN - lnN0 = ln(N/N0). (5)
Это выражение отличается от прежнего последним слагаемым, которое можно приписать к изменению начала отсчёта величины S. Величина N/N0 = p и есть вероятность осуществления интересующих нас событий. Сумма вероятностей всех возможных событий равна единице, как это следует определения.
Обращая логарифмическое выражение (5), получим p = exp(S). Поскольку мы рассматриваем ситуации, когда система находится преимущественно в состоянии с максимальной энтропией S*, и вероятность нахождения в этом состоянии близка к единице,– заметные флуктуации могут быть только при малых отклонениях от S*. Если разложить выражение (5) для S вблизи его максимума S* по переменной, которая характеризует состояния (как, например, величина k в рассмотренных примерах с комнатами), то для этих примеров получится выражение:
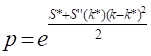
в котором S¢¢(k*) – вторая производная энтропии при значении переменной, соответствующем наиболее вероятному состоянию, а exp(S*) = p* – вероятность нахождения в преимущественном состоянии, величина, близкая к единице.
Чтобы почувствовать результат, рассмотрим опять первый пример с комнатами. Там S(k) = n(lnn -1) – k(lnk – 1) – (n – k). Вычисляя от этого выражения вторую производную в точке k = k* = n/2 , получим S¢¢(n/2) = – 4/n. Из этого следует, что p = exp. Эта функция имеет максимум при k = k*, и она уменьшается примерно в 10 раз, когда (k – k*)2/n = 1. Следовательно, в одном случае из 10 регистраций в комнате будет примерно (n/2 + Ön) человек. Если людей в помещении много (допустим n = 100), то их относительное изменение 2/Ön =0.2. И чем больше людей, тем меньше относительные флуктуации их числа. Из этих оценок следует, что при большом числе элементов в системе можно наблюдать только их малые относительные изменения.
Так, в пробирке с газом при атмосферном давлении число молекул (элементов в системе) порядка 1020 штук. В этих условиях в одном из десяти замеров можно будет обнаружить, что относительные отличия чисел молекул в двух половинах сосуда будут в пределах 10-8 %. Если имеется намерение обнаружить различие чисел молекул около 1%, что соответствует k = 0.99 n/2, то вероятность этого p = exp означает абсолютную невозможность осуществления намерения из-за огромного времени ожидания такого события.
В рассмотренном примере оказалось, что в наиболее вероятном состоянии вторая производная энтропии по переменной, характеризующей состояние системы, обратно пропорциональна n – числу элементов в ней. И поэтому выражение для вероятности имеет вид:
p = exp(– d2n), (6)
где d- величина порядка относительной флуктуации. Доказано, что такая формула применима в общем случае для оценки вероятности флуктуации заданной величины. Казалось бы, чем больше элементов в системе, тем больше в ней беспорядка и тем меньше определённости в состоянии системы. Однако формула (6) показывает характерную черту статистического принципа: чем больше элементов в системе, тем менее заметны относительные отклонения от вполне определённого доминирующего состояния.
Величина энтропии определялась пока только количеством элементов в системе (как людей, так и стульев в рассмотренных примерах). Естественно, что состояния системы могут определяться и другими ее параметрами, изменения которых также определяют число ее возможных состояний. Одна из самых важных таких характеристик – содержащаяся в системе энергия.
При объединении двух систем с различным содержанием в них энергии, разумеется, произойдёт её перераспределение. Проблема распределения энергии между элементами в системе подобна такой экономической задаче: в большом коллективе сначала некоторую его часть снабдили деньгами, а остальную оставили без денег. Спрашивается, как распределятся в конечном счёте деньги в коллективе, если считать, что взаимоотношения в коллективе сводятся к денежным (т.е. деньги перераспределяются между людьми в процессе взаимодействия) и искомое распределение определяется статистическим принципом.
Вопрос о распределении денег это вопрос о том, сколько людей в коллективе имеет заданное количество денег. Это число людей характеризует и их доля в коллективе, т.е. вероятность встретить в коллективе человека с заданной суммой денег. Если учесть, что у каждого человека сумма его денег всё время меняется в процессе взаимодействия с окружением, то можно предположить, что, вместо того чтобы определять искомую вероятность как долю коллектива, можно, понаблюдав за одним человеком в течение длительного времени, определить, какую часть этого времени у него была заданная сумма. Предположение о том, что определённая такими разными способами характеристика распределения денег окажется одинаковой, составляет содержание так называемой эргодической гипотезы.
Следуя этой гипотезе, поставим задачу так: какова вероятность p(m) иметь заданную сумму денег m одному из людей. Решим эту задачу, исходя из принципа максимума энтропии у всего коллектива N людей, у которых M денег.
По определению p(m) – вероятность иметь m монет – определяется отношением всех различных вариантов распределения (M – m) монет среди (N – 1) людей к общему числу всех возможных распределений M монет среди N людей. Число различных состояний системы выражается через энтропию S как exp(S). Отношение вероятностей p(m1)/p(m2) иметь m1 и m2 монет равно величине exp, которая для M >> m1, m2 приближённо, но с достаточно высокой точностью выражается как exp . Отсюда следует, что p(m) ~ exp.
Производная по M от энтропии системы, "состоящей" из людей и монет, характеризует увеличение в ней беспорядка с ростом M. В этой задаче, как и в задаче о расположении людей на стульях, число всех способов распределения M монет среди N людей равно (N + M – 1)! / M! (N – 1)!. Далее, логарифмируя это выражение, заменяя полученное на приближённое и вычисляя от него производную по M, получим S(M) = ln(1 + N/M) » N/M с учётом того, что, как считалось, на одного человека приходится в среднем много монет: M/N = μ >> 1.
В результате получается экспоненциальный закон распределения денег в рассматриваемой системе: p(m) = exp(–m/μ)/μ , где последний постоянный множитель определяется из условия равенства единице суммы p(m) по всем m от 0 до M.
При обмене между элементами системы энергией, а не монетами, в рассмотрении изменяется только зависимость энтропии от Е - параметра, характеризующего состояние системы. Если считать, что энергия при обмене передается маленькими порциями, подобно мелкой монете в предыдущем рассмотрении, то распределение по энергии будет иметь также экспоненциальный вид, с заменой величины μ на соответствующее значение средней энергии.
Принцип максимума энтропии позволяет выяснить смысл величины S¢(E) в общем случае. При соединении двух систем с разным начальным содержанием энергии E1 и E2 и E1 + E2 = E, после обмена энергией установится термодинамическое равновесие с максимумом суммарной энтропии при некотором значении энергии U в первой системе и остальной энергией (E – U) во второй. Поскольку условию максимума энтропии соответствуют равенства: S¢(U) = ¢ = 0, легко убедиться, что в состоянии равновесия S1¢ = S2¢. Таким образом, оказывается, что при соприкосновении систем с разным содержанием энергии выравниваются не их энергии, как можно было бы ожидать, а производные энтропии по энергии. А поскольку из опыта известно, что при контакте нагретых тел выравниваются их температуры, и при этом происходит обмен теплом (энергией), то уместно связать S¢(E) с температурой.
Величина S¢(E) действительно оказывается обратно пропорциональной температуре. Это означает, что температура может выражаться и в энергетических единицах. При данном толковании температуры, из условия максимума энтропии в состоянии термодинамического равновесия получается описание известного явления – остывания горячего и нагрева холодного тела при их соединении. Таким образом, выясняется, что выравнивание температур объясняется не действием каких-то сил, а тем, что наибольший беспорядок наиболее предпочтителен среди всех возможных состояний систем.
Можно перенести данное рассмотрение на гипотетическую экономическую ситуацию. Так, более богатые сообщества можно уподобить более нагретым системам. Если человек переселяется из одного сообщества в сообщество с другой “температурой”, или с другой средней обеспеченностью, то через некоторое время обеспеченность прибывшего станет равной “температуре” окружения.
Новое понимание смысла температуры заставляет выяснить новый смысл понятия теплоты. Широко распространено понимание теплоты как одной из форм энергии. Современное научное понимание теплоты иное, но удивительно, что по инерции и по ряду других причин даже учёные нередко говорят о теплоте как о форме энергии.
Чтобы разобраться в том, что такое теплота, поставим следующий вопрос: можно ли сказать, сколько теплоты содержится в конкретном теле? Очевидно, что можно, если измерить, сколько энергии отдаст тело при его охлаждении до нуля градусов и ничего при этом в теле не изменится. Но, как известно, при охлаждении тела сжимаются, и поэтому для измерения указанным способом количества тепла необходимо предотвратить самопроизвольное сжатие тела. Кроме этого при охлаждении возможны и другие изменения в теле, которые тоже нужно предотвратить. Поэтому практически измерить количество тепла, содержащегося в теле, непросто.
Проблема определения понятия теплоты аналогична следующей проблеме из области экономики. Можно ли сказать, сколько богатства у организации, например, банка. С одной стороны, можно, если представить, что банк изолирован и изъяты все его деньги. Но у банка многое находится не в денежной форме, например, его финансовые отношения с внешним миром, и их нельзя "взять" как деньги. Далее, при изъятии денег банк может получить кредит со стороны и т.д. Это подобно тому, как совершается работа системой за счёт окружающей среды (термостата) при изотермическом расширении системы.
Интересная похожесть, если не близость, проблем из экономики и естествознания не удивительна, так как выше говорилось, что законы природы формулируют люди. И хотя этих законов не так уж и много, они способны описывать разные по сути явления.
Определённо можно говорить о полной энергии системы, или об абсолютной ценности, если таковая существует. Энергия системы состоит из ее разных видов, и они могут превращаться друг в друга при изменениях состояния системы. Есть часть полной энергии, которая превращается в тепло, но величина этой части получается разной в зависимости от хода и пути изменения системы. При нагреве системы – передаче ей известного количества тепла – его часть переходит в другие виды энергии системы. Таким образом, получается, что тепло эта та часть полной энергии системы, которая остаётся, если вычесть из неё все остальные виды энергии. В этом и состоят особенности этого вида энергии. Другая особенность тепла состоит в том, что в различных процессах из-за взаимопревращений эта часть энергии получается разной. В термодинамике показывается, что эта, не определяемая состоянием системы величина выражается через введенные выше понятия температуры и энтропии. Именно, малое изменение количества тепла в системе dQ определяется как величина пропорциональная dS – изменению энтропии системы, а коэффициентом пропорциональности является температура T:
dQ = T dS. (7)
Изменение теплоты происходит только при определённой форме передачи энергии между телами. Эта специальная форма в большинстве случаев называется тепловым контактом.
Такое формальное определение тепла можно пояснить на "экономическом" примере ситуации с банком. При контакте двух банков они могут обмениваться своими состояниями по-разному. Если начальная “температура банков” – средняя ценность всего, что составляет систему банка – разная и в результате контакта их “температура” выровнялась, то количество ценностей, которое перешло при этом выравнивании из одного банка в другой и следует назвать переданным “теплом”.
При передаче тепла от одной части системы к другой энтропия системы увеличивается, и именно это определяет изменение количества тепла в системе. В таких процессах известные формы энергии превращаются друг в друга посредством тепла. Отсюда и проистекает смысл слова энтропия – превращение.
Передача тепла от горячего тела к холодному происходит самопроизвольно, и направленность этого процесса определяет закон возрастания энтропии. В природе все самопроизвольные процессы идут в направлении возрастания энтропии. Процесс в обратном направлении, например, передача холодным телом части своего тепла горячему, возможен только при затрате энергии. Эти утверждения составляют содержание т.н. второго закона (начала) термодинамики. Есть различные его формулировки. Все они требуют разъяснений того, что подразумевается. Этот закон, как и большинство законов природы, встречается и в форме запрещения. Наиболее яркая формулировка такая: невозможно создание вечного двигателя второго рода. Вечный двигатель первого рода должен работать без затраты энергии. Вечный двигатель второго рода должен работать за счёт тепла своего окружения. В частности, второй закон утверждает, что невозможно обогревать комнату зимой за счёт наружного тепла.
Направленность самопроизвольных процессов в природе определяет конечное состояние Вселенной. Согласно второму началу, Вселенную в будущем ожидает т.н. тепловая смерть. Это состояние с максимальной энтропией, которой соответствует полная однородность всей Вселенной. Сейчас Вселенная сильно неоднородна: в ней есть скопления масс, большие различия температур, неравновесные процессы, в частности, такое явление как жизнь. Согласно гипотезе тепловой смерти всё это должно исчезнуть и навсегда.
В настоящее время эта гипотеза считается некорректной, так как обычное толкование энтропии неприменимо к такой особой системе как Вселенная по ряду причин. Во-первых, силы гравитации не позволяют выделить отдельные несвязанные друг с другом части всей системы, и, таким образом, энтропия Вселенной не слагается из энтропий её частей. Во-вторых, Вселенная из-за своего расширения нестационарная и поэтому принципиально не может находиться в равновесии. Это, однако, не ниспровергает второй закон термодинамики. Просто его применимость ограничивается масштабами рассматриваемых равновесных систем и явлений.
Условия применимости второго закона термодинамики выясняются и в других ситуациях. Одну из этих ситуаций представляет парадокс Гиббса. Рассмотрим этот парадокс на примере объединения двух разных газов в одинаковых количествах. Будем считать, что вначале каждый газ был в одном из двух одинаковых сосудов. Согласно принципу максимума энтропии, в результате объединения сосудов получится одинаковое число разных атомов в каждом сосуде. Увеличение энтропии в результате смешения можно рассчитать, подобно сделанному в рассмотренных выше примерах с людьми и комнатами. Это увеличение равно N ln2, где N – количество всех атомов. Такой результат легко понять исходя из того, что энтропия системы слагается из энтропии ее N составляющих, а энтропия одного атома определяется числом его возможных нахождений в сосудах, равным 2. Таким образом, изменение энтропии для одного атома равно ln2.
Изменение энтропии определяет тепловой эффект перемешивания. Если температура газов Т поддерживалась постоянной при смешивании, то на обеспечение этого процесса было израсходовано T ln2 энергии на каждый атом. Эта энергия была получена из окружающей среды, обеспечивающей неизменность температуры процесса, в ходе которого каждая составляющая расширила свой объём и при этом произвела работу за счёт своего охлаждения. Такой вывод подтверждается опытом.
Аналогичное рассуждение можно привести и для случая смешивания одинаковых газов. Но смешивание одинаковых газов не приводит к новому состоянию, и на опыте оно не сопровождается тепловым эффектом. Таким образом, получается парадоксальная ситуация, ставящая вопрос о смысле различимых состояний систем.
В настоящее время парадокс Гиббса решается в физике с привлечением квантовых представлений о правильном описании состояния систем частиц. Однако, проблема, связанная с парадоксом Гиббса, состоит в раскрытии смысла понятий различия и схожести. Для физики, где все измерения и тем самым выявления схожести и различия связаны с энергией, проблема решается просто. Именно: если есть условия, при которых два объекта имеют в одном месте разную энергию, то такие объекты можно разделить, и они различимы. Так, смесь разных газов можно разделить и вернуть в исходное состояние различными способами. Наиболее наглядный среди них – разделение с помощью полупроницаемой перегородки, своего рода сита, которое пропускает по-разному разные атомы.
Очевидно, нет такого сита, которое разделило бы одинаковые атомы, отличающиеся только по признаку места их нахождения перед смешиванием.
Но нет никакой трудности практического разделения смеси пронумерованных одинаковых предметов. Однако нумерация предметов не энергетическая, а информационная характеристика. Поэтому для решения проблем, связанных со смешиванием и разделением информационно разных предметов, термодинамические принципы, хотя и оказываются полезными, неуместны.
Роль информации в термодинамических вопросах особая. Это хорошо иллюстрируется примером Демона Максвелла, в котором рассматривается гипотетическое устройство, где ожидается нарушение второго закона термодинамики.
Устройство состоит из двух камер, разделённых стенкой с маленькой дверкой в ней. В обеих камерах находится одинаковый газ, и в начальном состоянии давления (концентрации) газа и температуры в камерах одинаковы. Иными словами, газ находится в состоянии термодинамического равновесия. Утверждается, что при известной конструкции дверки равновесие системы нарушится. В частности, возможно нагревание одной из половин за счёт охлаждения другой или увеличение давления в одной камере при уменьшении его в другой.
Рассмотрим вторую возможность. Пусть дверка, как обычная дверь, открывается только в одну сторону и удерживается прижатой с помощью пружинки. Тогда атомы, способные открыть дверцу при ударе об неё, могут влететь в чужую камеру. В обратную сторону дверь при ударе не открывается, и обратного движения атомов нет. В такой ситуации концентрации в камерах станут неравными. Это неравенство даст избыточное давление на стенку, которое может совершить работу. Таким образом, второе начало будет опровергнуто.
Детальное рассмотрение действия такого устройства весьма сложно. Но можно объяснить, почему в устройстве не будет нарушения второго закона. Открывание дверцы требует затраты энергии. На открывание тратится тепловая энергия атомов при переходе в другую камеру. Таким образом, в камере, где концентрация увеличится, температура уменьшится, и давление при этом не изменится. Поэтому система не сможет совершить работу.
Так будет, если дверца массивная по сравнению с атомом. Если же дверца будет крайне лёгкой, сопоставимой с весом атома, то причина, по которой устройство не совершит работу, будет иной. Лёгкая дверца будет сама двигаться из-за собственного теплового движения. Эти флуктуационные движения аналогичны броуновскому. Образно говоря, дверца будет хлопать как ставня на ветру. В моменты спонтанного открытия дверцы атомы будут летать между камерами беспрепятственно.
И, наконец, можно автоматически открывать дверцу для подходящего атома. Работа автоматического устройства требует затрат энергии не только на открывание дверцы, но и на информационное обеспечение автоматики. Поэтому понятно, что созданию вечного двигателя второго рода в этом случае помешают непроизводительные затраты энергии.
Остаётся ещё возможность использования некоего разумного живого существа, или демона, который обеспечил бы нарушение второго закона термодинамики. В этом случае, как выразился Эйнштейн, “в среде, находящейся в равновесии, разумный механизм не может действовать”. Это значит, что жизнь и тем более сознание невозможны в системах, находящихся в термодинамическом равновесии.
В повседневной жизни проявления термодинамического неравновесия встречаются гораздо чаще, чем равновесные ситуации. Наиболее впечатляющими неравновесными системами являются Вселенная и живые существа. И в той и другой системах идут процессы в направлении, обратном по отношению к спонтанным. Живые существа возникают, развиваются и усложняются. Во Вселенной рождаются новые структуры. Как же это возможно? Как возникло неравновесное устройство Мира?
Причина этого в следующем. На начальной стадии образования Вселенной (во время большого взрыва) в состоянии материи, в соответствии с принципами термодинамики, возникали флуктуации. При быстром расширении Вселенной эти флуктуации не успели сгладиться и сохранились подобно осколкам разорвавшейся бомбы. Так Вселенная оказалась неоднородной. Одни места нагреты, другие холодные, кое-где сосредоточены громадные скопления вещества, а почти всюду вещества мало. В настоящее время где-то во Вселенной энтропия, возможно, уменьшается, подобно тому, как это происходит при жизнедеятельности в Солнечной системе, в которой энтропия нарастает. Но поскольку ко всей Вселенной принцип самопроизвольного нарастания энтропии не применим,– возникновение структур во Вселенной, возможно, процесс вечный.
Неоднородность и неравновесность во Вселенной обеспечивают потоки энергии разных видов. Так, потоки света Солнца обеспечивают Землю энергией. Потоки энергии совершают работу, подобно потокам воды рек, дающих электроэнергию, которую можно расходовать на создание нужных неравновесных условий. Потоки тепла приводят в действие машины. Электрический ток преобразуется в механическое движение. Так что потоки энергии всех видов – основа противодействия росту энтропии в процессах, связанных с жизнедеятельностью.
Явление жизни основано на метаболизме – процессах обмена веществом и энергией с внешней средой. Так что через живой организм проходит поток энергии и вещества. Для поддержания этого нужно быть чрезвычайно сложной системой. Как из неорганизованной материи получилась такая сложная система, до сих пор нет полной ясности. Но нет сомнений, что свойство живого усложняться основывается также на преобразованиях потоков, идущих через организм живого и подчиняющихся законам термодинамики.
Рассмотренные попытки нарушения второго начала наводят на вопрос о затратах энергии, требуемых для создания и поддержания неравновесных состояний. Среди этих вопросов особый интерес вызывают затраты на работу сознания. То, что работа сознания требует больших затрат энергии, очевидно свидетельствуют и шум вентиляторов компьютеров и острое чувство голода у студентов в период интенсивных занятий.
В настоящее время актуальной проблемой становится минимизация затрат на производство и хранение информации. Ее решение связано с выяснением понятия ценности информации. Можно полагать, что ценность информации определяется компактностью ее формулировки и многообразием следствий (сведений), получаемых при использовании этой информации для решения различных проблем. Очевидно, что в этом плане Законы Природы представляют собой особо ценную информацию, обладатель которой – богатый человек. Правда, для воплощения этого богатства требуется умение применять эти Законы на практике.
Поможем написать любую работу на аналогичную тему

