Химический состав воды – весь сложный комплекс минеральных и органических веществ, находящиеся в различных формах природно-молекулярном и коллоидном состоянии. Условно химический состав можно подразделить на 5 групп:
Главные ионы
Их содержание в наибольшем количестве
Хлориды, карбонаты, сульфаты, гидрокарбонаты, ионы натрия, кальция, магния, калия.
Растворенные газы
Кислород, углекислый газ, сероводород, метан, азот
Биогенные элементы
Азот, фосфор, кремний, железо
Органические вещества
Микроэлементы
Радионуклиды
Хлорид ионы. Содержание их изменяется в самых широких пределах. В реках и озерах, особенно северных районов, с заболоченными и подзолистыми почвами содержание хлорида в воде ничтожно мало и измеряется миллиграммами и даже десятыми миллиграмма в литре. С увеличением же минерализации воды содержание хлорида увеличивается как абсолютно, так и относительно прочих ионов. В морях и значительной части соляных озер хлорид является главным анионом. Встречаются озера, в которых количество хлорида достигает 170 г/кг и выше.•Хлоридные ионы имеют исключительно широкое распространение в природных водах, и хотя иногда и в очень малых количествах, но все же присутствуют почти во всех природных водах. Поэтому круговорот их в земной коре сравнительно несложен, однако, вследствие обилия NaCI на земной поверхности, протекает в огромных масштабах и в нем принимают участие •колоссальные залежи хлористых солей осадочных пород. Помимо осадочных" пород, источником ионов 'С1' в воде •могут быть и продукты .выветривания магматических пород, в которых хлорид присутствует в рассеянном состоянии, главным образом в виде хлорпатита Са5 (Р04)3 С1 и содалита 3NaAlSi04NaCl. Наконец, значительная часть хлоридов попадает в воду с вулканическими выбросами.
Сульфатные ионы. Сульфатные ионы являются важнейшими анионами природной воды и вместе с ионами хлорида составляют главную часть анионного состава воды морей и сильно минерализованных озер. В водах с большой минерализацией содержание ионов S04" обычно уступает хлоридам, но в большей части умеренно минерализованных и особенно в маломинерализованных водах они значительно преобладают.
Содержание SO4' в. природных водах лимитируется присутствием в воде ионов Са", которые образуют с S04" сравнительно малорастворимый CaS04. Основными источниками растворенных в воде сульфатов
являются различные осадочные породы, в состав которых входит гипс (CaSO4*2Н2О). Источниками SO4' в природной воде служат и процессы окисления самородной серы, протекающие по уравнения
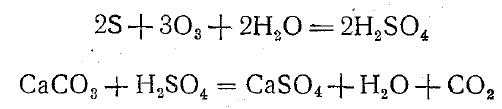
Значительные количества сульфидов, и особенно Н2S, выделяются при вулканических извержениях и окисляются до SO4'. На содержание сульфатов в природных водах оказывают влияние процессы распада и окисления органических веществ растительного и животного происхождения, содержащих серу. Поэтому вблизи населенных пунктов присутствие SO4' в воде, особенно грунтовой, часто является результатом загрязнения ее промышленными и бытовыми отбросами. Сульфатные ионы не являются устойчивыми, так как сера в природных условиях проходит сложный круговорот, в который в значительной мере вовлечены и сульфаты, находящиеся в природных водах. При отсутствии кислорода сульфаты могут быть восстановлены до сероводорода. Такого рода процесс, например протекающий в глубинных зонах морей и в водах нефтеносных месторождений, ранее объяснялся восстановлением сульфатов органическим веществом, и в этом случае он может быть изображен следующей схемой:
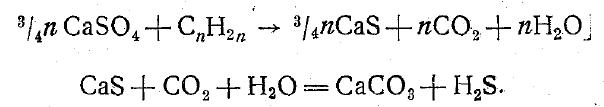
Ионы щелочных металлов. Из ионов щелочных металлов в природных водах в наибольших количествах находятся ионы Na', в значительно меньших количествах — К'. Подобно хлорид ионам. ионы натрия являются характерными ионами сильно минерализованных вод. В маломинерализованных водах содержание их очень невелико —в пределах нескольких миллиграммов, реже— нескольких десятков миллиграммов на 1 л.Важнейшим источником Na в природных водах являются его залежи (преимущественно в виде хлористых солей), находящиеся среди различных осадочных пород морского, а в засушливых районах и континентального происхождения.
Ионы магния и кальция. Ионы магния встречаются почти во всех природных водах и по общему количеству среди катионов они уступают только натрию. Вместе с тем сравнительно редко встречаются воды, где доминирующими катионами являются ионы Mg". Обычно же в маломинерализованных водах доминирует Са ", в сильно минерализованных — Na'. Основным источником Са" в природных водах являются известняки. Они растворяются угольной кислотой, находящейся в воде, которая вступает с ними во взаимодействие по уравнению
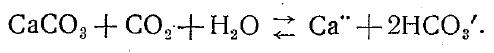
Реакция эта обратима, и содержание Са" и НС03' в растворе зависит, как видно из уравнения, от находящейся в равновесии с ними двуокиси углерода. Уменьшение количества последней вызывает протекание реакции справа налево и перевод гидрокарбонатных ионов в карбонатные, которые с иона-
ми Са" образуют труднорастворимый СаС03, выпадающий в виде осадка. Это наблюдается, например, при выходе подземных источников с большим содержанием НС03' на земную поверхность, при котором резкое уменьшение парциального давления С02 вызывает выделение С02 в атмосферу и выпадение СаС03 в виде известкового туфа (рис. 12). В еще большей мере это происходит в океане, куда реки выносят большое
количество Са" и НС03'.Из образующихся пересыщенных растворов СаС03 извлекается организмами, употребляющими его на построение своего скелета. После отмирания этих организмов из их остатков
образуются мощные пласты известняков, которые с течением" времени, при поднятии дна океана, оказываются на поверхности земли. Именно таким путем образовались многочисленные залежи известняков на земной поверхности. О. масштабахданного процесса выделения СаС03 можно судить по размерам 'образующихся пластов, достигающих сотен метров, как, например, толща силурийских известняков вблизи южного побережья Финского залива. Карбонаты кальция, помимо указанного процесса образования известняков, получаются в природных условиях и при разрушении горных пород, в частности алюмосиликатов, благодаря чему они широко распространены на земной поверхности. В результате растворения, при взаимодействии воды и С02, рассеянных всюду карбонатов ионы Са" могут появляться в самых различных водах, даже в совершенно не связанных с известняковыми осадочными породами.
Другим источником Са" в природных водах является гипс, весьма распространенный в осадочных породах (особенно в известняках, мергелях, доломитах), часто в больших количествах. Ионы магния поступают в воду преимущественно при растворении доломитов (MgC03 • СаС03), мергелей или продуктов выветривания коренных пород (биотит, оливин, амфибол и др.). Растворение карбоната магния идет при этом совершенно аналогично СаС03, но растворимость MgC03 значительно выше
![]()
Ион Са" является главным катионом маломинерализованных вод, но с ростом минерализации воды его относительное содержание быстро уменьшается. Гидрокарбонатный и карбонатный ионы. Ионы НСО3 и С03" являются важнейшей частью ионного состава природных, особенно маломинерализованных, вод. Появляются эти ионы в воде в результате растворения, солей угольной кислоты—карбонатов кальция и магния. Соли СаС03 и MgC03 трудно растворимы в воде и могут перейти в раствор только в присутствии двуокиси углерода, причем растворение их в этом случае происходит по следующим уравнениям:
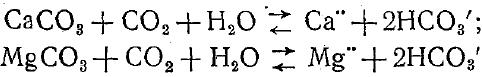
основном из СаС03 и MgC03. Вообще процесс выпадения карбонатов имеет громадное значение для образования и разрушения многих осадочных пород [и формирования химичёского состава природных вод. Кроме того, он определяет ряд важнейших технических качеств воды (образование накипи, агрессивные свойства воды и др.).
Поможем написать любую работу на аналогичную тему
Реферат
Дайте характеристику состава природных вод, отразив роль главных ионов в процессах формирования и метаморфизации.
От 250 руб
Контрольная работа
Дайте характеристику состава природных вод, отразив роль главных ионов в процессах формирования и метаморфизации.
От 250 руб
Курсовая работа
Дайте характеристику состава природных вод, отразив роль главных ионов в процессах формирования и метаморфизации.
От 700 руб

