Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, вязкость, сжимаемость, электропроводность, а также радиоактивность. Чистая вода не имеет запаха, вкуса, цвета. Цвет, вкус и запах, прозрачность природных вод определяются содержанием определенных веществ и их концентраций.
Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты.
Вода реагирует со многими металлами с выделением водорода:
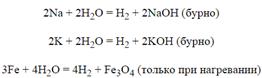
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
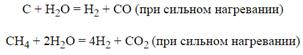
Вода разлагается на водород и кислород при действии электрического тока.
![]()
Вода реагирует со многими оксидами неметаллов
![]()
![]()
![]()
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.

Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты.
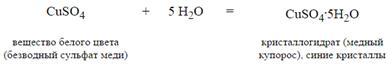
рН воды
Ионы водорода появляются даже в химически чистой воде, в результате ее частичной диссоциации
![]()
Степень ее диссоциации очень мала, и из 10 000 000 молекул воды только одна распадается на ионы. Выражая концентрацию веществ, образующихся в результате диссоциации воды, в соответствии с законом действующих масс, имеем
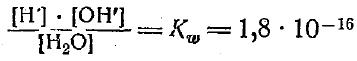
Величина есть количество грамм-молей недиссоциированной воды в 1 л, т. е. 1000/18. Подставляя эту величинув данное уравнение, получим так называемое ионное произведение воды
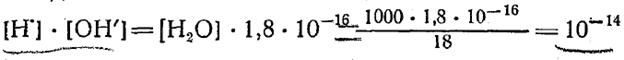
При диссоциаций молекулы воды получается равное число ионов Н' и ОН', поэтому ионные концентрации их равны, т. е.=.
Следовательно, в химически чистой воде
![]()
Носителем кислотных свойств в растворе является ион водорода , а основных свойств — гидрофильный ион . В химически чистой воде они присутствуют в равных количеcтвах, поэтому химически чистая вода является строго нейтральной.
Принято концентрацию Н" выражать через ее степенной показатель, взятый с обратным знаком, обозначая ее в этом случае через особый символ рН. Следовательно, рН = -lg.
В природной воде, являющейся сложным раствором, концентрация ионов Н' зависит не от диссоциации собственно воды, а главным образом от соотношения количества угольной кислоты и ионов НС03' и С03" и в меньшей мере —от остальных ионов. Угольная кислота диссоциирует на ионы
![]()
Выражая концентрации реагирующих веществ в соответствии с законом действия масс, получим
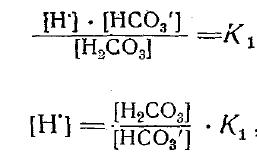
т. е. концентрация ионов водорода прямо пропорциональна количеству Н2С03 и обратно пропорциональна содержанию НСО3-. Поэтому в водах, где наблюдается скопление С02, величина рН обычно уменьшается и, наоборот, при выделении С02 из воды величина рН увеличивается. В воде, не содержащей растворенных солей, вследствие растворения угольного ангидрида реакция становится слабо кислой
Виды концентраций.
Для выражения концентраций растворов существует несколько способов:
1) массовая концентрация — отношение массы какого-либо компонента, содержащегося в растворе, к общему объему раствора. Она выражается в г/л или г/дм3 (и в кратных им единицах: г/мл, мг/л, мг/мл и т. д.);
2) молярная концентрация, или молярность — отношение количества вещества, содержащегося в растворе, к объему раствора. Примеры указания молярной концентрации С (X):
![]()
3) моляльная концентрация, или моляльность — отношение количества вещества, содержащегося в растворе, к массе растворителя;
4) молярная концентрация эквивалента — отношение количества вещества эквивалента, содержащегося в растворе, к общему объему раствора. В некоторых реакциях, в частности нейтрализации, окисления — восстановления и ионообмена, принимает участие не целая частица X, а лишь ее часть, называемая эквивалентом. Эквивалент есть 1/Z части частицы. При Z = l эквивалент идентичен самой частице. Отношение количества вещества эквивалента n(1/z) в молях к объему системы называется молярной конц в-ва экв-та. Единица: моль/м3 и моль/л. Запись:
![]()
При определении понятий: молярная концентрация, мольная концентрация, моляльная концентрация эквивалента использовано выражение «количество вещества». Количество вещества — это основная величина, характеризующая размер порции вещества, численностью содержащихся в ней частиц. Последние могут быть атомами, молекулами, ионами, электронами, эквивалентами. Единицей количества вещества является моль.
Поможем написать любую работу на аналогичную тему
Реферат
Опишите физические и химические свойства воды; водородного показателя. состав растворов; виды концентраций; растворимость.
От 250 руб
Контрольная работа
Опишите физические и химические свойства воды; водородного показателя. состав растворов; виды концентраций; растворимость.
От 250 руб
Курсовая работа
Опишите физические и химические свойства воды; водородного показателя. состав растворов; виды концентраций; растворимость.
От 700 руб

