Живые организмы с точки зрения термодинамики – открытые системы. Между системой и окружающей средой возможен обмен энергии, который происходит в соответствии с законами термодинамики. Каждое органическое соединение, поступающее в организм, обладает определенным запасом энергии (Е). Часть этой энергии может быть использована для совершения полезной работы. Такую энергию называют свободной энергией (G). Направление химической реакции определяется значением DG. Если эта величина отрицательна, то реакция протекает самопроизвольно. Такие реакции называются экзергоническими. Если DG положительно, то реакция будет протекать только при поступлении свободной энергии извне – это эндергонические реакции. В биологических системах термодинамически невыгодные эндергонические реакции могут протекать лишь за счет энергии экзергонических реакций. Такие реакции называют энергетически сопряженными.
Важнейшей функцией многих биологических мембран служит превращение одной формы энергии в другую. Мембраны, обладающие такими функциями, называются энергопреобразующими. Любая мембрана, выполняющая энергетическую функцию, способна к превращению химической энергии окисляемых субстратов или АТФ в электрическую энергию, а именно в трансмембранную разность электрических потенциалов (DY) или в энергию разности концентраций веществ, содержащихся в разделенных мембраной растворах, и наоборот. Среди энергопреобразующих мембран, имеющих наибольшее значение, можно назвать внутреннюю мембрану митохондрий, внешнюю цитоплазматическую мембрану, мембраны лизосом и комплекса Гольджи, саркоплазматический ретикулум. Наружная мембрана митохондрий и ядерная мембрана не может превращать одну форму энергии в другую.
Преобразование энергии в живой клетке описывается следующей общей схемой:
Энергетические ресурсы ® DmI ® работа
где DmI – трансмембранная разность электрохимических потенциалов иона I. Следовательно, процессы утилизации энергии и совершения за счет нее работы оказываются сопряжены через образование и использование DmI. Поэтому данный ион может быть назван сопрягающим ионом. Основным сопрягающим ионом в клетке эукариот является Н+, и соответственно DmН+ является основной конвертируемой формой запасания энергии. Вторым по значимости сопрягающим ионом является Na+ (DmNa+). В то время как Сa2+, K+ и Cl- не используются для совершения какой-либо работы.
Биологическое окисление – это процесс дегидрирования субстрата с помощью промежуточных переносчиков водорода и его конечного акцептора. Если в роли конечного акцептора выступает кислород, процесс называется аэробным окислением или тканевым дыханием, если конечный акцептор представлен не кислородом – анаэробным окислением. Анаэробное окисление имеет ограниченное значение в организме человека. Основная функция биологического окисления – обеспечение клетки энергией в доступной форме.
Тканевое дыхание – процесс окисления водорода кислородом до воды ферментами цепи тканевого дыхания. Оно протекает по следующей схеме:
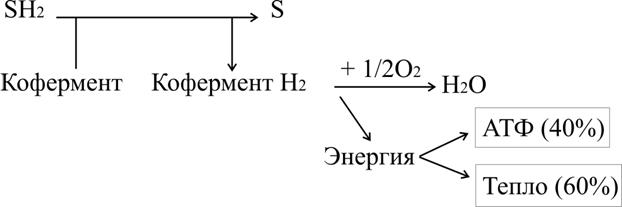
Вещество окисляется, если отдает электроны или одновременно электроны и протоны (атомы водорода), или присоединяет кислород. Способность молекулы отдавать электроны другой молекуле определяется окислительно-восстановительным потенциалом (редокс-потенциалом). Любое соединение может отдавать электроны только веществу с более высоким окислительно-восстановительным потенциалом. Окислитель и восстановитель всегда образуют сопряженную пару.
Выделяют 2 типа окисляемых субстратов:
Пиридинзависимые – спиртовые или альдегидные – изоцитрат, α-кетоглутарат, пируват, малат, глутамат, b-гидроксиацил-КоА, b-гидроксибутират, – в их дегидрировании участвуют НАД-зависимые дегидрогеназы.
Флавинзависимые – являются производными углеводородов – сукцинат, ацил-КоА, глицерол-3-фосфат, холин – при дегидрировании передают водород на ФАД-зависимые дегидрогеназы.
Цепь тканевого дыхания – последовательность переносчиков протонов водорода (Н+) и электронов от окисляемого субстрата на кислород, локализованных на внутренней мембране митохондрий.

Рис. 10.1. Схема ЦТД
Компоненты ЦТД:
НАД-зависимые дегидрогеназы дегидрируют пиридинзависимые субстраты и акцептируют 2ē и один Н+.
ФАД (ФМН) - зависимые дегидрогеназы акцептируют 2 атома водорода (2Н+ и 2ē). ФМН – зависимая дегидрогеназа дегидрирует только НАДН, в то время как ФАД- дегидрогеназы окисляют флавинзависимые субстраты.
Жирорастворимый переносчик убихинон (кофермент Q, КоQ) – свободно перемещается по мембране митохондрий и акцептирует два атома водорода и превращается в КоQH2 (восстановленная форма – убихинол).
Система цитохромов – переносит только электроны. Цитохромы железосодержащие белки, простетическая группа которых по структуре напоминает гем. В отличие от гема атом железа в цитохроме может обратимо переходить из двух – в трехвалентное состояние (Fe3+ + ē « Fe2+). Это и обеспечивает участие цитохрома в транспорте электронов. Цитохромы действуют в порядке возрастания их редокс-потенциала и в дыхательной цепи располагаются следующим образом: b - с1 – с – а - а3. Два последних работают в ассоциации как один фермент цитохромоксидаза аа3. Цитохромоксидаза состоит из 6 субъединиц (2 - цитохрома а и 4 - цитохрома а3). В цитохроме а3 кроме железа имеются атомы меди и он передает электроны непосредственно на кислород. Атом кислорода при этом заряжается отрицательно и приобретает способность взаимодействовать с протонами с образованием метаболической воды.
Железосерные белки (FeS) – содержат негемовое железо и участвуют в окислительно-восстановительных процессах, протекающих по одноэлектронному механизму и ассоциированы с флавопротеинами и цитохромом b.
Структурная организация цепи тканевого дыхания
Компоненты дыхательной цепи во внутренней мембране михохондрий формируют комплексы:
I комплекс (НАДН-КоQН2-редуктаза) – принимает электороны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов.
II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2.
Убихинон легко перемещается по мембране и передает электроны на III комплекс.
III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД.
IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи.
Существует 2 разновидности ЦТД:
Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы
Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса.
Окислительное фосфорилирование АТФ
Окислительное фосфорилирование – процесс образования АТФ, сопряженный с транспортом электронов по цепи тканевого дыхания от окисляемого субстрата на кислород. Электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, поэтому их транспорт по ЦТД сопровождается снижением свободной энергии. В дыхательной цепи на каждом этапе снижение свободной энергии происходит ступенчато. При этом можно выделить три участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Эти этапы способны обеспечить энергией синтез АТФ, так как количество выделяющейся свободной энергии приблизительно равно энергии, необходимой для синтеза АТФ из АДФ и фосфата.
Для объяснения механизмов сопряжения дыхания и фосфорилирования выдвинут ряд гипотез.
Механохимическая или конформационная (Грин-Бойера). В процессе переноса протонов и электронов изменяется конформация белков-ферментов. Они переходят в новое, богатое энергией конформационное состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ.
Гипотеза химического сопряжения (Липмана). В сопряжении дыхания и фосфорилирования участвуют «сопрягающие» вещества. Они акцептируют протоны и электроны и взаимодействуют с Н3РО4. В момент отдачи протонов и электронов связь с фосфатом становится макроэргической и фосфатная группа передается на АДФ с образованием АТФ путем субстратного фосфорилирования. Гипотеза логична, однако до сих пор не выделены «сопрягающие» вещества.
Хемиоосмотическая гипотеза Питера Митчелла (1961г.)
Основные постулаты этой теории:
внутренняя мембрана митохондрий непроницаема для ионов Н+ и ОН−;
за счет энергии транспорта электронов через I, III и IV комплексы дыхательной цепи из матрикса выкачиваются протоны;
возникающий на мембране электрохимический потенциал является промежуточной формой запасания энергии;
возвращение протонов в матрикс митохондрии через протонный канал АТФ синтазы является поставщиком энергии для синтеза АТФ по схеме
АДФ+Н3РО4«АТФ+Н2О
Доказательства хемиоосмотической теории:
- на внутренней мембране есть градиент Н+ и его можно измерить;
- создание градиента Н+ в митохондрии сопровождается синтезом АТФ;
- ионофоры (разобщители), разрушающие протонный градиент, тормозят синтез АТФ;
- ингибиторы, блокирующие транспорт протонов по протонным каналам АТФ-синтазы, ингибируют синтез АТФ.
Строение АТФ-синтазы
АТФ-синтаза – интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи и обозначается как V комплекс. АТФ-синтаза состоит из 2 субъединиц, обозначаемых как Fо и F1. Гидрофобный комплекс Fо погружен во внутреннюю мембрану митохондрий и состоит из нескольких протомеров, образующих канал по которому протоны переносятся в матрикс. Субъединица F1 выступает в митохондриальный матрикс и состоит из 9 протомеров. Причем три из них связывают субъединицы Fо и F1, образуя своеобразную ножку и являются чувствительными к олигомицину.
Суть хемиоосмотической теории: за счет энергии переноса электронов по ЦТД происходит движение протонов через внутреннюю митохондриальную мембрану в межмембранное пространство, где создается электрохимический потенциал (DmН+), который приводит к конформационной престройке активного центра АТФ-синтазы, в результате чего становится возможным обратный транспорт протонов через протонные каналы АТФ-синтазы. При возвращении протонов назад электрохимический потенциал трансформируется в энергию макроэргической связи АТФ. Образовавшаяся АТФ с помощью белка-переносчика транслоказы перемещается в цитозоль клетки, а взамен в матрикс поступают АДФ и Фн.
Коэффициент фосфорилирования (Р/О) – число атомов неорганического фосфата, включенных в молекулы АТФ, в пересчете на один атом использованного поглощенного кислорода.
Пункты фосфорилирования – участки в дыхательной цепи, где энергия транспорта электоронов используется на генерацию протонного градиента, а затем в ходе фосфорилирования запасается в форме АТФ:
1 пункт – между пиридинзависимой и флавинзависимой дегидрогеназами; 2 пункт – между цитохромами b и с1; 3 пункт – между цитохромами а и а3.
Следовательно, при окислении НАД-зависимых субстратов коэффициент Р/О равен 3, так как электроны от НАДН транспортируются с участием всех комплексов ЦТД. Окисление ФАД-зависимых субстратов идет в обход I комплекса дыхательной цепи и Р/О равен 2.
Нарушения энергетического обмена
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов деятельности. Нарушение какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Ткани с высокими энергетическими потребностями (ЦНС, миокард, почки, скелетные мышцы и печень) являются наиболее уязвимыми. Состояния, при которых синтез АТФ снижен объединяют термином «гипоэнергетические». Причины данных состояний можно разбить на две группы:
Алиментарные – голодание и гиповитаминозы В2 и РР – возникает нарушение поставки окисляемых субстратов в ЦТД или синтез коферментов.
Гипоксические – возникают при нарушении доставки или утилизации кислорода в клетке.
Регуляция ЦТД. Осуществляется с помощью дыхательного контроля.
Дыхательный контроль – это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ. Чем меньше это отношение, тем интенсивнее идет дыхание и активнее синтезируется АТФ. Если АТФ не используется, и его концентрация в клетке возрастает, то прекращается поток электронов к кислороду. Накопление АДФ увеличивает окисление субстратов и поглощение кислорода. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой может изменяться в десятки раз.
Американский биохимик Д.Чанс предложил рассматривать 5 состояний митохондрий, при которых скорость их дыхания ограничивается определенными факторами:
1. Недостаток SH2 и АДФ – скорость дыхания очень низкая.
2. Недостаток SH2 при наличии АДФ – скорость ограничена.
3. Есть SH2 и АДФ – дыхание очень активно (лимитируется только скоростью транспорта ионов через мембрану).
4. Недостаток АДФ при наличии SH2 – дыхание тормозится (состояние дыхательного контроля).
5. Недостаток кислорода, при наличии SH2 и АДФ – состояние анаэробиоза.
Митохондрии в покоящейся клетке находятся в состоянии 4, при котором скорость дыхания определяется количеством АДФ. Во время усиленной работы могут пребывать в состоянии 3 (исчерпываются возможности дыхательной цепи) или 5 (недостаток кислорода) – гипоксии.
Ингибиторы ЦТД – это лекарственные препараты, которые блокируют перенос электронов по ЦТД. К ним относят: барбитураты (амитал), которые блокируют транспорт электронов через I комплекс дыхательной цепи, антибиотик антимицин блокирует окисление цитохрома b; монооксид углерода и цианиды ингибируют цитохромооксидазу и блокируют транспорт электронов на кислород.
Ингибиторы окислительного фосфорилирования (олигомицин) – это вещества, которые блокируют транспорт Н+ по протонному каналу АТФ-синтазы.
Разобщители окислительного фосфорилирования (ионофоры) – это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов по ЦТД. Механизм действия разобщителей сводится к тому, что они являются жирорастворимыми (липофильными) веществами и обладают способностью связывать протоны и переносить их через внутреннюю мембрану митохондрий в матрикс, минуя протонный канал АТФ-синтазы. Выделяющаяся при этом энергия рассеивается в виде тепла.
Искусственные разобщители – динитрофенол, производные витамина К (дикумарол), некоторые антибиотики (валиномицин).
Естественные разобщители – продукты перекисного окисления липидов, жирные кислоты с длинной цепью, большие дозы йодсодержащих гормонов щитовидной железы, белки термогенины.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Митохондрии бурой жировой ткани продуцируют больше тепла, так как присутствующий в них белок термогенин разобщает окисление и фосфорилировние. Это имеет важное значение в поддержании температуры тела новорожденных.
Поможем написать любую работу на аналогичную тему

