Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Аминокислоты непосредственно участвуют в биосинтезе большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклеотидов, гема, креатина, холина и др.
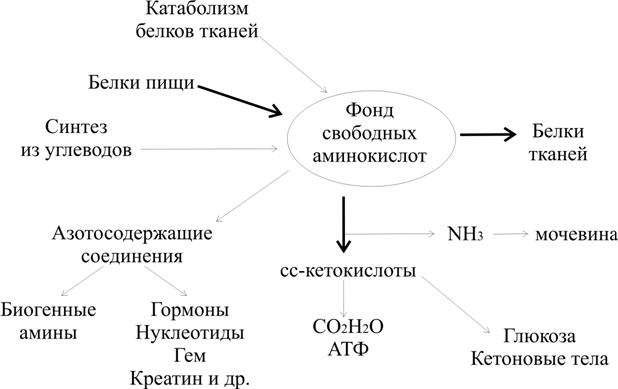
Рис. 23.1. Общая схема метаболизма аминокислот в организме
Катаболизм аминокислот является источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет). Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме.
Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека составляет примерно 15 кг.
Какой-либо специальной формы депонирования аминокислот и белков, подобно глюкозе или жирным кислотам не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Период полураспада белков различен – от нескольких минут до нескольких суток. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируется только углеродная часть молекулы, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
Показателем, отражающим интенсивность аминокислотного обмена, является азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей).
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
- денатурирует белки;
- стерилизует пищу;
- вызывает набухание труднорастворимых белков;
- активирует пепсиноген;
- создает рН-оптимум для действия пепсина;
- способствует всасыванию железа;
- вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5-2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0-4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Всасывание аминокислот.
Происходит путем активного транспорта с участием переносчиков. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приема белковой пищи. Перенос через щеточную каемку осуществляется целым рядом переносчиков, многие из которых действую при участии Na+-зависимых механизмов симпорта. Причем аминокислоты конкурируют друг с другом за специфические участки связывания. Выяснено, что существуют транспортные системы, переносящие аминокислоты определенного строения: нейтральные с небольшим радикалом, нейтральные с объемным радикалом, кислые, основные и иминокислоты.
В настоящее время, расшифрован механизм транспорта аминокислот в клетки кишечника, мозга, почек, получивший название g-глутамильного цикла Майстера, ключевым ферментом которого является g-глутамилтрансфераза.
Всосавшиеся аминокислоты попадают в портальный кровоток и, следовательно, в печень, а затем в общий кровоток. Освобождается кровь от свободных аминокислот очень быстро – уже через 5 мин 85-100% их оказывается в тканях. Особенно интенсивно аминокислоты поглощаются печенью и почками.
Наследственные нарушения транспорта аминокислот
Болезнь Хартнупа – нарушение всасывания триптофана в кишечнике и его реабсорбции в почечных канальцах. Так как триптофан служит исходным продуктом для синтеза витамина РР, то основные проявления болезни Хартнупа – дерматиты, диарея и деменция, характерные для пеллагры.
Цистинурия – нарушение реабсорбции цистина в почках. Цистин плохо растворим в воде, поэтому выпадает в виде кристаллов, которые приводят к образованию цистиновых камней в почках и мочевыводящих путях.
Расщепление белков в тканях
Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:
- создание биологически активных пептидов путем ограниченного протеолиза белковых предшественников;
- разрушение состарившихся и аномальных белков;
- участие в фагоцитозе и делении клеток;
- участие в аутолизе (при ишемии);
- участие в патогенезе заболеваний, связанных с изменением функций лизосом (лизосомальные болезни накопления).
Кроме процессов протеолиза в лизосомах возможен процесс разрушения эндогенных белков непосредственно в цитозоле. При этом происходит соединение подлежащих гидролизу белков со специальным белком убиквитином. Происходит ковалентная модификация белка, что может изменять его функцию. К одной молекуле может быть присоединено несколько молекул убиквитина и это служит сигналом для переноса белка-мишени на большую высокомолекулярную частицу протеасому, состоящую из протеаз.
Превращение аминокислот микрофлорой кишечника
Микроорганизмы кишечника располагают набором ферментативных систем, отличных от соответствующих ферментов тканей организма человека и катализирующих самые разнообразные превращения пищевых аминокислот и не переваренных белков, в том числе и по несвойственным человеку метаболическим путям (гнилостный распад). В результате образуются два типа веществ:
- токсические продукты: фенол, крезол, индол, скатол, сероводород, амины, меркаптан;
Нетоксические продукты: кетокислоты, оксикислоты, жирные кислоты, спирты.
Обезвреживание токсических веществ происходит путем образования парных нетоксичных продуктов при соединении с 3-фосфоаденозин-5-фосфосульфатом (ФАФС, активированная форма серной кислоты), либо с уридиндифосфоглюкуроновой кислотой (УДФ-глюкуронат).
При кишечных инфекциях (дизентерия, брюшной тиф, холера) образуется во много раз большое количество продуктов гнилостного распада аминокислот, которые вызывают общую интоксикацию организма, нарушение проницаемости мембран слизистой оболочки кишечника, приводящее к поносам, обезвоживанию тканей и повышению температуры тела. Кроме того, возрастает активность декарбоксилаз патогенных бактерий, в результате образуются амины, создающие картину инфекционного заболевания.
Пути обмена аминокислот в тканях
Аминокислоты – это бифункциональные соединения, содержащие аминную и карбоксильную группу. Реакции по этим группам являются общими для различных аминокислот. К ним относят:
- по аминной группе – реакции дезаминирования и трансаминирования;
- по карбоксильной группе – реакции декарбоксилирования.
Кроме этих общих путей возможны реакции по углеводородному радикалу аминокислот, которые являются специфическими для каждой аминокислоты.
Катаболизм большинства аминокислот начинается с отщепления a-аминогруппы, которое возможно в реакциях трансаминировани и дезаминирования.
Трансаминирование аминокислот
Трансаминирование – реакции переноса a-аминогруппы с аминокислоты на a-кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота. Реакции катализируют ферменты аминотрансферазы. Это сложные ферменты, коферментом которых является производное витамина В6 – пиридоксальфосфат, который обратимо может переходить в пиридоксаминфосфат. Реакции трансаминирования обратимы, и могут проходить как в цитоплазме, так и в митохондриях клеток. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
Реакции трансаминирования протекают в 2 стадии. На первой стадии к пиридоксальфосфату в активном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент- пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин).
На второй стадии пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции.
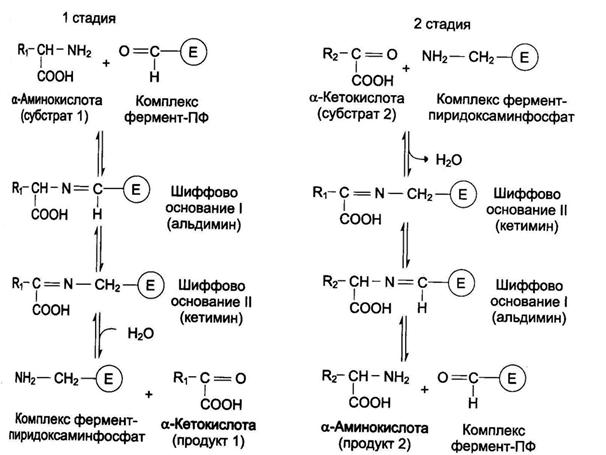
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных – глутамат, аланин, аспартат. Наиболее распространенными в большинстве тканей являются аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ).
Наибольшая активность АсАТ обнаруживается в клетках сердечной мышцы и печени, в то время как в крови обнаруживается только фоновая активность АлАТ и АсАТ. Поэтому можно говорить об органоспецифичности этих ферментов, что позволяет их широко примененятьих с диагностической целью (при инфарктах миокарда и гепатитах).
Биологическое значение трансаминирования
Трансаминирование – первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они необходимы в данный момент клеткам. В результате происходит перераспределение аминнного азота в тканях. При трансаминированиии общее количество аминокислот в клетке не меняется.
Оксидазы D-аминокислот. При физиологических значениях рН в тканях высоко активны оксидазы D-аминокислот. Они также обнаружены в почках и печени и находятся в микросомах. Роль оксидаз D-аминокислот невелика и до конца не понятна, потому что в белки пищи и тканей человека входят только природные L-аминокислоты.
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования серина, треонина, цистеина и гистидина неокислительным путем.
Дезаминирование аминокислот
Дезаминирование аминокислот – реакция отщепления a-аминогруппы от аминокислоты с выделением аммиака. Различают два типа реакций дезаминирования: прямое и непрямое.
Прямое дезаминирование – непосредственное отщепление аминогруппы от аминокислоты без промежуточных посредников. В живой природе возможны следующие типы прямого дезаминирования: окислительное, восстановительное, гидролитическое и путем внутримолекулярной перестройки. Но у человека дезаминирование происходит преимущественно окислительным путем в результате чего образуется соответствующая a-кетокислота и выделяется аммиак. Процесс идет с участием ферментов оксидаз. Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
Окислительное дезаминирование глутамата
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, который несколько отличается от типичных оксидаз L-аминокислот:
- в качестве кофермента содержит НАД+ или НАДФ+;
- обладает абсолютной специфичностью;
- высокоактивна;
- локализована в митохондриях.
Реакция идет в 2 этапа. Вначале происходит дегидрирование глутамата и образование a-иминоглутарата, затем – неферментативное гидролитическое отщепление имминогруппы в виде аммиака, в результате чего образуется a-кетоглутарат. Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака может протекать в обратном направлении, как восстановительное аминирование a-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органах, кроме мышц. Она является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы – АТФ, ГТФ, НАД(Ф)Н. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетке стимулирует разрушение аминокислот и образование a-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом) и ингибироваться эстрогенами и тироксином.
Непрямое дезаминирование аминокислот
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот перносятся на a-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования или непрямого дезаминирования. Он происходит с участием 2 ферментов аминотрансферазы и глутаматдегидрогеназы. Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование – основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей a-кетокислоты. Обратная последовательность реакций, при которой происходит синтез аминокислот из кетокислот, получила название трансреаминирования.

В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует еще один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Образующийся при этом аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Декарбоксилирование аминокислот
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию. Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами, нуждающимися в пиридоксальфосфате в качестве кофермента. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическре действие на организм, и поэтому названы биогенными аминами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
Биогенные амины
Гистамин образуется при декарбоксилировании гистидина в тучных клетках соединительной ткани. В организме человека выполняет следующие функции:
- стимулирует секрецию желудочного сока и слюны;
- повышает проницаемость капилляров, вызывает отеки, снижает АД, но увеличивает внутричерепное давление, вызывая головную боль;
- сокращает гладкую мускулатуру легких, вызывает удушье;
- участвует в формировании воспалительных реакций – расширение сосудов, покраснение, отечность ткани;
- вызывает аллергическую реакцию;
- нейромедиатор;
- медиатор боли.
Серотонин – образуется при декарбоксилировании и дальнейшем окислении триптофана. Биологические функции:
- оказывает мощное сосудосуживающее действие;
- повышает кровяное давление;
- участвует в регуляции температуры тела, дыхания;
- медиатор нервных процессов в ЦНС (обладает антидепрессантным действием).
Дофамин образуется при декарбоксилировании диоксифенилаланина (ДОФА). При дальнейшем окислении и метилировании образуюся адреналин и норадреналин. Дофамин является нейромедиатором, контролирующим произвольные движения, эмоции и память. В высоких концентрациях дофамин стимулирует адренорецепторы, увеличивает силу сердечных сокращений, повышает сопротивление периферических сосудов (с параллельным увеличением почечного и коронарного кровотока). Кроме того, дофамин тормозит секрецию пролактина и соматотропина.
В нервных клетках декарбоксилирование глутамата приводит к образованию g-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса.
Цикл превращений ГАМК в мозге включает три сопряженных реакции, получивших название ГАМК-шунта. Первую катализирует глутаматкарбоксилаза. Эта реакция является регуляторной и обеспечивает скорость образования ГАМК в клетках мозга. Последующие 2 две реакции можно считать реакциями катаболизма ГАМК. ГАМК-аминотрансфераза образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат затем используется в цикле Кребса. Инактивация ГАМК возможна и окислительным путем под действием моноамионоксидазы.
При декарбоксилировании орнитина образуется путресцин, который является предшественником биологически активных веществ спермина и спермидина. Путресцин, спермин и спермидин имеют большой положительный заряд, легко связываются с отрицательно заряженными молекулами ДНК и РНК, входят в состав хроматина и участвуют в репликации РНК. Кроме того эти вещества стабилизируют структуру мембран клеток.
Этаноламин образуется при декарбоксилировании серина. В организме используется для синтеза холина, ацетилхолина, фосфатидилэтаноламинов, фосфатидилхолинов.
При декарбоксилировании лизина образуется кадаверин, который является трупным ядом.
Для осуществления биологической функции в организме требуется определенная концентрация биогенных аминов. Избыточное их накопление может вызвать различные патологические отклонения. В связи с этим большое значение приобретают механизмы их инактивации:
- окисление ферментами моноаминооксидазами (МАО) (кофермент ФАД). Таким путем чаще всего инактивируются дофамин, норадреналин, серотонин и ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками.
- метилирование с участием S-аденозилметионина. Таким путем чаще всего инактивируются катехоламины – фермент катехол-орто-метилтрансфераза (КОМТ)
- окисление с помощью диаминооксидаз – инактивация гистамина, а также короткоцепочечных алифатических диаминов (путресцина и кадаверина).
Пути катаболизма углеродного скелета аминокислот
Трансаминирование и дезаминирование аминокислот ведет к образованию безазотистых углеродных скелетов аминокислот – α-кетокислот. В состав белков входят 20 аминокислот, различающихся по строению углеводородного радикала, каждый из которых катаболизируется по своим специфическим метаболическим путям.
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, a-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат.
Аминокислоты, которые превращаются в промежуточные продукты ЦТК (a-кетоглутарат, сукцинил-КоА, фумарат), и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты называются гликогенными. К ним относятся: аланин, аргинин, аспартат, глутамат, глицин, гистидин, метионин, пролин, серин, треонин, валин, цистеин.
Катаболизм лейцина и лизина не включает стадии образования пировиноградной кислоты, их углеводородная часть превращается непосредственно в ацетоацетат (лейцин, лизин) или в ацетил-КоА (лейцин) и используются в синтезе кетоновых тел.
Тирозин, фенилаланин, изолейцин и триптофан являются смешанными или одновременно гликогенными и кетогенными. Часть углеродных атомов их молекул при катаболизме образует пируват, другая часть включается в ацетил-КоА, минуя стадию пирувата.
Истинной кетогенной аминокислотой является лейцин.
Поможем написать любую работу на аналогичную тему

