Печень занимает центральное место в обмене веществ и выполняет многообразные функции:
1. Гомеостатическая - регулирует содержание в крови веществ, поступающих в организм с пищей, что обеспечивает постоянство внутренней среды организма.
2. Биосинтетическая – осуществляет биосинтез веществ «на экспорт» (белки плазмы крови, глюкоза, липиды, кетоновые тела и др.).
3. Обезвреживающая – в печени происходит обезвреживание токсических продуктов метаболизма (аммиак, продукты гниения белков в кишечнике, билирубина и др.), чужеродных соединений и лекарственных веществ.
4. Пищеварительная - связана с синтезом желчных кислот, образованием и секрецией желчи.
5. Выделительная (экскреторная) – обеспечивает выделение некоторых продуктов метаболизма (холестерол, желчные пигменты) с желчью в кишечник.
6. Инактивация гормонов, витаминов.
Большое значение печени определяется ее анатомическим положением. Это промежуточный орган между кишечником и системой общего кровотока. Благодаря печени в общем круге кровообращения изменения концентрации ряда веществ, поступающих в организм с пищей (глюкоза, аминокислоты и др.), незначительны.
Масса печени составляет 2-3% от веса тела, у взрослого человека – 1,2 – 2 кг.
Масса печени и её химический состав подвержены изменениям, в особенности, при патологических состояниях. Для осуществления обменных функций печень получает от 1/4 до 1/3 крови минутного объема сердца, что составляет около 1,5 литра в минуту. 70% крови поступает в печень по воротной вене, 30 % - по печеночной артерии.
Роль печени в углеводном обмене
Основная роль печени в углеводном обмене заключается в поддержании нормального содержания глюкозы в крови – т. е. в регуляции нормогликемии. Это достигается за счет нескольких механизмов.
1. Наличие в печени фермента глюкокиназы. Глюкокиназа, подобно гексокиназе, фосфорилирует глюкозу до глюкозо-6-фосфата. Следует отметить, что глюкокиназа в отличие от гексокиназы, содержится, только в печени и β-клетках островков Лангерганса. Активность глюкокиназы в печени в 10 раз превышает активность гексокиназы. Кроме того, глюкокиназа в противоположность гексокиназе имеет более высокое значение Кm для глюкозы (т. е. меньшее сродство к глюкозе).
После приема пищи содержание глюкозы в воротной вене резко возрастает и достигает 10 ммоль/л и более. Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и увеличивает поглощение глюкозы печенью. Благодаря синхронной работе гексокиназы и глюкокиназы печень быстро и эффективно фосфорилирует глюкозу до глюкозо-6-фосфата, обеспечивая нормогликемию в системе общего кровотока. Далее глюкозо-6-фосфат может метаболизироваться по нескольким направлениям (рис. 28.1).

Рис. 28.1. Участие глюкозо-6-фосфата в метаболизме углеводов
2. Синтез и распад гликогена. Гликоген печени выполняет роль депо глюкозы в организме. После приема пищи избыток углеводов откладывается в печени в виде гликогена, уровень которого составляет примерно 6 % от массы печени (100-150 г). В промежутках между приемами пищи, а также в период «ночного голодания» пополнения пула глюкозы в крови за счет всасывания из кишечника не происходит. В этих условиях активируется распад гликогена до глюкозы, что поддерживает уровень гликемии. Запасы гликогена истощаются к концу 1-х суток голодания.
3. В печени активно протекает глюконеогенез – синтез глюкозы из неуглеводных предшественников (лактат, пируват, глицерол, гликогенные аминокислоты). Благодаря глюконеогенезу в организме взрослого человека образуется примерно 70 г глюкозы в сутки. Активность глюконеогенеза резко возрастает при голодании на 2-е сутки, когда запасы гликогена в печени исчерпаны.
Благодаря глюконеогенезу печень участвует в цикле Кори – процессе превращения молочной кислоты, образующейся в мышцах, в глюкозу.
4. В печени осуществляется превращение фруктозы и галактозы в глюкозу.
5. В печени происходит синтез глюкуроновой кислоты.
Роль печени в липидном обмене
Печень участвует во всех этапах липидного обмена, начиная с переваривания липидов и заканчивая специфическими метаболическими превращениями отдельных липидных фракций:
- синтез желчных кислот и образование желчи;
- β-окисление жирных кислот;
- биосинтез жирных кислот;
- образование кетоновых тел;
- распад и синтез фосфолипидов;
- синтез холестерола и образование его эфиров; соотношение эфиры холестерина/свободный холестерин в норме составляет примерно 0,5 – 0,7 %; снижение этого коэффициента до 0,3 – 0,4 % наблюдается при поражениях печени и является неблагоприятным признаком;
- основное место синтеза липопротеинов очень низкой плотности и липопротеинов высокой плотности;
- гидроксилирование витамина D по 25-му положению.
Роль печени в обмене аминокислот и белков
Печень играет центральную роль в обмене белков и других азотсодержащих соединений. Она выполняет следующие функции:
- синтез специфических белков плазмы: - в печени синтезируется: 100 % альбуминов, 75 – 90 % α-глобулинов, 50 % β-глобулинов,
единственный орган, где синтезируются белки свертывающей системы крови – протромбин, фибриноген, проконвертин, проакцелерин;
- активно протекают реакции трансаминирования и дезаминирования аминокислот;
- биосинтез мочевины происходит исключительно в печени;
- образование мочевой кислоты происходит в основном в печени, так как здесь много фермента ксантиноксидазы, при участии которого продукты распада пуриновых оснований (гипоксантин и ксантин) превращаются в мочевую кислоту;
- синтез креатина и холина.
В печени происходит детоксикация различных веществ.
Обезвреживающая функция печени
Печень является главным органом, где происходит обезвреживании естественных метаболитов (билирубин, гормоны, аммиак) и чужеродных веществ. Чужеродными веществами, или ксенобиотиками, называют вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей или в качестве источников энергии. К ним относят лекарственные препараты, продукты хозяйственной деятельности человека, вещества бытовой химии и пищевой промышленности (консерванты, красители).
Обезвреживание нормальных метаболитов
1. Обезвреживание пигментов.
В клетках ретикулоэндотелиальной системы печени протекает катаболизм гема до билирубина, конъюгация билирубина с глюкуроновой кислотой в гепатоцитах и распад в гепатоцитах поступающего из кишечника уробилиногена до непигментных продуктов.
2. Обезвреживание аммиака.
Аммиак – высокотоксичное соединение, особо опасное для мозга. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины в печени. Мочевина – малотоксичное соединение и легко выводится из организма с мочой.
3. Инактивация гормонов.
Печени принадлежит значительная роль в инактивации гормонов. Многие пептидные гормоны гидролизуются в печени при участии протеолитических ферментов. Например, фермент инсулиназа гидролизует пептидные цепи А и В инсулина. Катаболизм адреналина и норадреналина происходит в печени путем дезаминирования моноаминооксидазой, метилирования и конъюгации с серной и глюкуроновой кислотами. Продукты метаболизма выводятся с мочой.
Обезвреживание ксенобиотиков
Обезвреживание большинства ксенобиотиков происходит в 2 фазы:
I – фаза химической модификации;
II – фаза коньюгации.
Химическая модификация – это процесс ферментативной модификации исходной структуры ксенобиотика, в результате которой происходит:
- разрыв внутримолекулярных связей;
- присоединение к молекуле дополнительных функциональных групп (-СН3, -ОН, -NH2),
- удаление функциональных групп путем гидролиза.
Типы модификаций:
- окисление (микросомальное, пероксисомальное);
- восстановление;
- изомеризация;
- ацетилирование, метилирование, гидроксилирование;
- гидролиз и т.д.
Система обезвреживания включает множество разнообразных ферментов (оксидоредуктазы, изомеразы, лиазы, гидролазы), под действием которых практически любой ксенобиотик может быть модифицирован. Наиболее активны ферменты метаболизма ксенобиотиков в печени.
В результате химической модификации, как правило, ксенобиотики становятся более гидрофильными, повышается их растворимость, и они легче выделяются из организма с мочой. Кроме этого, дополнительные функциональные группы необходимы, чтобы вещество вступило в фазу конъюгации.
Коньюгация – процесс образования ковалентных связей между ксенобиотиком и эндогенным субстратом. Образование связей происходит, как правило, по ОН- или NH2-группе ксенобиотика. Образовавшийся коньюгат малотоксичен и легко выводится из организма с мочой.
Выделяют глюкуронидную, сульфатную, тиосульфатную, ацетильную коньюгации. В них принимают участие эндогенные соединения, образующиеся в организме с затратой энергии: УДФ-глюкуронат, ФАФС, тиосульфат, ацетил-КоА.
Катаболизм гемоглобина
1. Катаболизм гема.
Билирубин образуется при распаде гемоглобина (рис. 28.2). Этот процесс протекает в клетках печени, селезенки и костного мозга. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
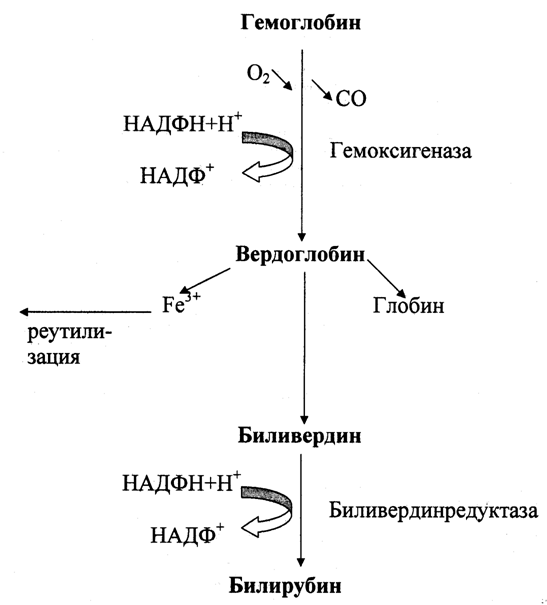
Рис. 28.2. Распад гемоглобина
2. Метаболизм билирубина.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным) или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует фермент УДФ-глюкуронилтрансфераза (рис. 28.3). Образующийся билирубиндиглюкуронид получил название прямого (коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
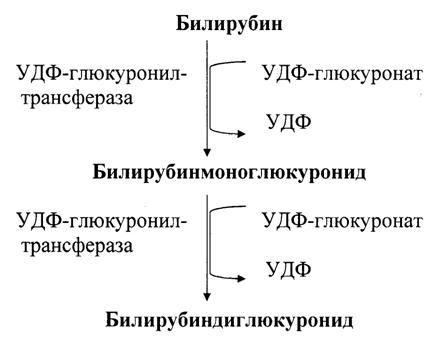
Рис. 28.3. Образование билирубиндиглюкуронида
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена (уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Распределение желчных пигментов в норме: кровь – общий билирубин – 8,5 – 20,5 мкмоль/л; непрямой билирубин – 1,7 – 17,1 мкмоль/л; прямой билирубин – 2,2 – 5,1 мкмоль/л; моча – стеркобилиноген – 4 мг/сутки; кал – стеркобилиноген.
Желтухи. Дифференциальная диагностика
Желтуха – это заболевание, характеризующееся желтой окраской кожи и слизистых в результате накопления билирубина. Основная причина этого явления – гипербилирубинемия. Причинами гипербилирубинемии могут быть:
- усиление гемолиза эритроцитов и увеличение образования билирубина, превышающее способность печени экскретировать его;
- повреждение печени, приводящее к нарушению секреции билирубина в желчь;
- закупорка желчевыводящих протоков печени.
Во всех случаях содержание билирубина в крови повышается. При достижении определенной концентрации (выше 50 мкмоль/л) он диффундирует в ткани, окрашивая их в желтый цвет.
Определение билирубина и других желчных пигментов в крови и в моче имеет важное значение для дифференциальной диагностики желтух различной этиологии.
1. Гемолитическая (надпеченочная желтуха)
Гемолитическая желтуха развивается вследствие интенсивного гемолиза эритроцитов при гемолитических анемиях, вызванных сепсисом, лучевой болезнью, переливанием несовместимых групп крови, отравлением сульфаниламидами и т. д. Усиленный гемолиз эритроцитов приводит к интенсивному образованию в клетках РЭС непрямого билирубина. Печень не способна утилизировать в короткое время весь образующийся непрямой билирубин, он накапливается в крови и тканях. Так как печень обезвреживает повышенное количество непрямого билирубина, в больших количествах образуется прямой билирубин в печени. Поступление значительных количеств билирубина в кишечник ведет к усиленному образованию и выделению с калом и мочой стеркобилиногена. Кал приобретает более интенсивное окрашивание.
Характерные признаки гемолитической желтухи:
- кровь – повышение общего билирубина и непрямого билирубина; концентрация прямого билирубина – в норме;
- моча – отсутствие билирубина и положительная реакция на стеркобилиноген (который в больших количествах, чем обычно, поступает в почки из толстого кишечника);
- кал – повышение количества стеркобилиногена (темная окраска).
2. Паренхиматозная (печёночная) желтуха.
Паренхиматозная желтуха обусловлена повреждением гепатоцитов при острых вирусных инфекциях, хроническом и токсическом гепатитах. Причина повышения концентрации билирубина – нарушение функций и некроз части печеночных клеток.
Биохимические нарушения.
1. В результате некроза гепатоцитов прямой билирубин частично попадает в кровь, его концентрация увеличивается. Прямой билирубин хорошо растворим в воде и экскретируется с мочой.
2. Экскреция жёлчи нарушена, в кишечник попадает меньше билирубина чем в норме, поэтому количество образующегося в толстом кишечнике стеркобилиногена также снижена. Кал гипохоличный.
3. При прогрессирующем гепатите нарушается процессы коньюгации билирубина в печени, вследствие этого в крови накапливается непрямой билирубин.
4. Нарушается процесс разрушения уробилиногена, поступающего в печень из кишечника по воротной вене. Он попадает в общий кровоток и экскретируется с мочой (в норме в моче отсутствует).
Характерные признаки паренхиматозной желтухи:
- кровь – повышение общего билирубина, прямого и непрямого билирубина;
- моча – положительная реакция на билирубин и уробилиноген, интенсивная окраска;
- кал – снижение количества стеркобилиногена, гипохоличный кал.
3. Механическая или обтурационная (подпеченочная) желтуха.
Механическая желтуха развивается при нарушении желчевыделения в двенадцатиперстную кишку. Основная причина – частичная или полная закупорка желчных протоков, например при жёлчно-каменной болезни, опухолях поджелудочной железы, желчного пузыря, печени. Так как нормальные пути экскреции коньюгированного билирубина заблокированы, происходит его поступление в кровь. В крови увеличивается содержание прямого билирубина, он выводится с мочой, придавая ей насыщенный оранжево-коричневый цвет. При полной закупорке общего желчного протока желчь не попадает в кишечник, не происходит образование стеркобилиногена, кал обесцвечен и в моче отсутствует уробилиноген.
Характерные признаки механической желтухи:
- кровь – повышение общего билирубина, прямого билирубина. При тяжелых формах механической желтухи может нарушаться детоксикационная функция печени и уровень непрямого билирубина в крови также повышается. Однако прямого билирубина оказывается всегда больше непрямого;
- моча – положительная реакция на билирубин, уробилиноген отсутствует, интенсивная окраска;
- кал – резкое снижение или отсутствие стеркобилиногена, ахоличный кал.
Проявления обтурационной и паренхиматозной желтухи очень сходны. Критерием для дифференцированного диагноза является наличие уробилиногена в моче (при паренхиматозной желтухе) и резкое увеличение прямого билирубина в крови (при обтурационной).
Желтуха новорожденных
Разновидность гемолитической желтухи новорожденных − «физиологическая желтуха». Наблюдается в первые дни жизни ребенка. Причинами повышения концентрации непрямого билирубина в крови являются:
- усиленный гемолиз эритроцитов, содержащих фетальный гемоглобин;
- недостаточный синтез в печени УДФ-глюкуроната;
- недостаточность функции белков и ферментов печени, ответственных за поглощение, коньюгацию и секрецию прямого билирубина, в частности, значительно снижена активность УДФ-глюкуронилтрансферазы.
У детей в течение первых двух недель жизни коньюгирующая способность печени составляет 1/5 по сравнению с таковой у взрослых.
В тяжелых случаях желтухи новорожденных, когда концентрация билирубина в крови превышает 340 мкмоль/л, он проходит через гематоэнцефалический барьер головного мозга и вызывает его поражение (билирубиновая энцефалопатия). Легкая форма послеродовой гипербилирубинемии встречается практически у всех новорожденных.
Биохимические механизмы развития печеночной недостаточности
Печеночная недостаточность – состояние, объединяющее различные нарушения функции печени, которые могут в дальнейшем полностью компенсироваться, прогрессировать или длительно стабилизироваться. В тяжелых случаях печеночная недостаточность заканчивается печеночной комой.
Причиной печеночной недостаточности является целый ряд заболеваний и токсические агенты, вызывающие повреждения паренхимы печени:
- острый вирусный гепатит;
- алкогольный цирроз или цирроз другой этиологии;
- опухоли печени;
- обширные травмы или ожоги;
- сепсис;
- отравление гепатотропными ядами (ССl4) и лекарственными препаратами.
При печеночной недостаточности происходит снижение функций этого органа, которое и определяет клиническую картину в каждом конкретном случае. Естественно, что при печеночной недостаточности происходит не изолированное снижение какой-либо одной функции печени, а ряд этих функций изменяется в определенной степени. Наиболее важным фактором, определяющим тяжесть состояния, является нарушение белоксинтезирующей и обезвреживающей функций печени.
Признаки печеночной недостаточности:
- низкий уровень общего белка и альбуминов;
- снижение концентрации факторов свертывания крови, синтезируемых в печени (вначале снижается синтез YII фактора, затем – II, IX, X); удлинение протромбинового времени и развитие геморрагических проявлений;
- гипербилирубинемия;
- снижение концентрации мочевины в плазме крови и накопление аммиака;
- тяжелые нарушения обмена электролитов – гипокалемия, гипонатремия, гипокальцемия, развивается гипокалемический внеклеточный алкалоз в сочетании с внутриклеточным ацидозом, что усиливает токсическое действие аммиака;
- увеличение содержания в крови фенолов и производных индола, ароматических и серосодержащих аминокислот, низкомолекулярных жирных кислот (масляная, валерьяновая, капроновая и др.); эти соединения обладают церебротоксическим действием.
Повреждение печени обычно обратимо вследствие высокой регенеративной способности данного органа, но метаболические нарушения при печеночной недостаточности достаточно тяжелые. Накопление токсических веществ, в первую очередь, аммиака, билирубина и чужеродных соединений, является основной причиной развития энцефалопатии и наступления печеночной комы.
Биохимические методы диагностики поражений печени
Биохимические лабораторные тесты могут быть высокочувствительными индикаторами повреждения печени. Результаты биохимических анализов указывают на природу болезни печени, позволяют оценить степень тяжести патологического процесса и гораздо реже дают основания для постановки специфического диагноза.
Для оценки функционального состояния печени при разных заболеваниях (острый и хронический гепатит, цирроз, холестаз, опухоли) используют комплекс биохимических показателей и тестов.
- Исследование пигментного обмена – определение в крови и моче билирубина и продуктов его биотрансформации.
- Определение альбумина и других белков сыворотки крови позволяет оценить белоксинтезирующую функцию печени. Выраженность изменений зависит от тяжести и длительности заболевания (концентрация альбумина снижается только при хронических заболеваниях печени).
- Определение активности ряда ферментов:
- АсАТ и АлАТ – активность трансаминаз увеличивается при повреждении гепатоцитов;
- γ-глутамилтрансфераза (ГГТ), активность фермента является очень чувствительным, но не специфичным показателем заболеваний печени, ее изолированное повышение может быть следствием злоупотребления алкоголем;
- щелочная фосфатаза, её активность повышена при внутри- и внепеченочном холестазе.
- Определение активности специфических ферментов печени:
- фруктозо-1-фосфатальдолаза;
- сорбитолдегидрогеназа;
- орнитинкарбомоилтрансфераза;
- ЛДГ5.
Изменение активности этих ферментов специфично для повреждений печени и может быть использовано для тонкой диагностики заболеваний этого органа.
- Осадочные пробы – представляют группу методов, основанных на взаимодействии различных реагентов с коллоидной системой белков сыворотки крови, при котором развивается преципитационное помутнение или осаждение. Устойчивость коллоидной системы крови нарушается главным образом из-за диспротеинемии, развивающейся при хронических диффузных заболеваниях печени.
- Тимоловая проба – один из самых надежных тестов оценки функционального состояния печени.
- Цинк – сульфатная проба.
- Коагуляционная проба Вельтмана.
Поможем написать любую работу на аналогичную тему

