Причиной всех этих уникальных свойств ферментов является их пространственное строение. Все ферменты представляют собой глобулярные белки, намного превосходящие по размерам субстрат. Именно это обстоятельство, вместе с особенностями третичной структуры белков, привело к тому, что в процессе эволюции на поверхности фермента сформировался активный центр, комплементарный субстрату.
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 11). Активный центр - часть молекулы фермента, где происходит связывание и превращение субстрата. У фермента, имеющих четвертичную структуру, число АЦ может быть равно числу Субъединиц. Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
Условно активный центр можно разделить на две части — связывающий центр и каталитический центр. Связывающий центр (связывающая площадка) выполняет функцию специфического связывания субстрата и его оптимальной ориентации по отношению к катализирующим группам. Каталитический центр, непосредственно вступает в химическое взаимодействие с субстратом, и связывает центр, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: например, субстраты эстераз или протеиназ – одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
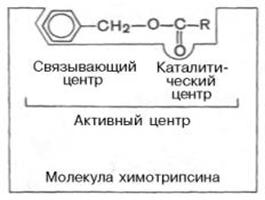
Рисунок 11 - Активный центр фермента (схема) (по Малеру и Кордесу)
Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации. Образовавшийся белок приобретает информацию совершенно нового типа, а именно функциональную (в частности, каталитическую). Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры, приводят к искажению или разрушению структуры активного центра и соответственно потере ферментом каталитических свойств. Если при подходящих внешних условиях удается восстановить нативную трехмерную структуру белка-фермента (ренатурировать его), то восстанавливается и его каталитическая активность.
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
В каталитическом центре сконцентрированы каталитические группы. Если для проведения реакции достаточно кислотно-основного катализа (гидролитические реакции вроде гидролиз амидной связи в белках или межнуклеотидной фосфатной связи), то каталитический центр формируется боковыми радикалами аминокислотных остатков белка. В этом случае фермент состоит только из полинуклеотидных цепей. Однако многие вещества, необходимые для жизнедеятельности клетки, могут быть получены только с помощью окислительно-восстановительных реакций или реакций переноса углеродсодержащих групп. Боковые радикалы аминокислотных остатков не могут катализировать такие реакции. В этом случае клетка использует составные ферменты, в которых белковая часть обеспечивает связывание субстрата, а катализ осуществляют небелковые (мономерные) соединения, называемые коферментом (кофактором, простетической группой). Белковая часть такого фермента называется апоферментом, а активный фермент (комплекс апофермента и кофермента) — холоферментом. В большинстве случаев кофермент связывается с апоферментом нековалентными взаимодействиями.
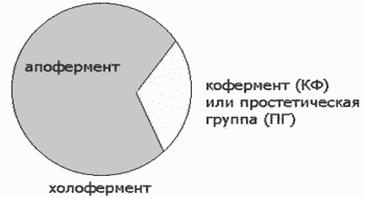
Рисунок 12 - Строение холофермента
Поможем написать любую работу на аналогичную тему

