Закон действующих масс – описывает взаимосвязь между концентрацией реагирующих веществ и скоростью химической реакции, обнаруженную русским ученым-химиком Н.Н. Бекетовым и голландскими химиками К. Гульдбергом и П. Вааге.
![]()
![]() aA + bB cC + dD
aA + bB cC + dD
Скорость Vп прямой химической реакции между А и В,по закону действующих масс, пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам реакции:
Vп = Kпаb,
где Kп – коэффициент пропорциональности, он равен скорости реакции при концентрациях веществ 1 моль/л.
В первый момент протекания реакции концентрации исходных веществ имеют наибольшее значение и скорость прямой реакции велика. При взаимодействии их концентрация падает и скорость уменьшается. При появлении в системе продуктов реакции и возрастании их концентраций увеличивается скорость обратной реакции. В момент равенства скоростей прямой и обратной реакции наступает химическое равновесие, при котором состав системы становится постоянным.
K
= ![]()
При химическом равновесии отношение произведения концентрации продуктов реакции к произведению концентраций исходных веществ есть величина постоянная, называемая константой химического равновесия (K).
Теории кислот и оснований:
Согласно теории Оствальда – Аррениуса: кислоты – электролиты, которые при диссоциации образуют протоны H+ и кислотный остаток; основания – электролиты, которые при диссоциации образуют гидроксильную группу и ион Me (NH4+).
Kд = ![]()
Согласно теории Бренстеда – Лоури: кислоты – доноры H+; основания – акцепторы H+.
Соединения, которые могут как отдавать, так и принимать H+, называются амфолиты.
В процессе передачи H+ образуются сопряженная пара кислоты и основания.
![]()
![]() NH4+ (кислота) NH3 (основание) + H+
NH4+ (кислота) NH3 (основание) + H+
![]()
![]() HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота)
HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота)
HCN и CN – сопряженная пара
Достоинством этой теории является возможность учесть влияние конкретного растворителя на кислотно-основное взаимодействие. K (NH4+) a (acid), K (NH3) b (basic).
Согласно теории Льюиса: кислоты – вещества, которые в своем строении имеют свободную орбиталь;
![]() BF3
BF3
![]() кислоты
кислоты
Cu2+
основания – вещества или частицы, которые имеют неподеленную электронную пару (:NH3).
![]() Cu2+ + NH3 2+
- кислотно-основное взаимодействие по Льюису.
Cu2+ + NH3 2+
- кислотно-основное взаимодействие по Льюису.
Эта теория расширила понятия о кислотах и основаниях, но недостатком ее является то, что классификация веществ по Льюису зависит от субъективного взгляда исследователя на природу химической связи.
Согласно теории Усановича: кислоты – вещества, которые отдают любые катионы и H+ и присоединяют любые анионы; основания отдают анионы, включая электроны, и принимают протоны.
ОВР – частный случай – недостаток этой теории.
В гомогенных системах для характеристики равновесия вводят понятие константы равновесия. Различают термодинамическую константу равновесия (K0), которая не учитывает побочных процессов и рассчитана для идеальных систем; реальную константу (K), которая учитывает параллельно протекающие процессы осаждения и комплексообразования; условную константу (K’), которая учитывает электростатические взаимодействия в системах.
Для того, чтобы отличать одну константу от другой по-разному обозначают концентрации реагирующих и полученных соединений.
Схема равновесия гомогенной системы:
![]()
![]() aA + bB cC + dD
aA + bB cC + dD
- K0 =
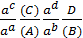 – термодинамическая константа равновесия K0, a – активная концентрация.
– термодинамическая константа равновесия K0, a – активная концентрация.
Для того, чтобы отличить термодинамическую константу K0 от другой константы, концентрации продуктов реакции и исходных веществ записывают в виде активной концентрации a.
Термодинамическая константа приводится в химических справочниках.
Для расчетов используется –lgK = pK.
- K =
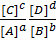 - реальная константа K
- реальная константа K
Концентрации записывают в виде равновесных.
- K’ =
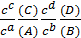 – условная константа K’.
– условная константа K’.
Концентрации в ней записываются в виде общих концентраций.
Мы исследуем реальную систему, поэтому необходимо учитывать влияние растворителя, силу электролитов, участвующих во взаимодействии, а также величину заряда и радиус ионов, которые находятся в растворе.
Эти взаимодействия определены теорий Дебая-Хюккеля:
полному взаимодействию исходных веществ в растворе мешает наличие ионов растворителя, а также величина заряда исходных веществ и соединений в растворе (ионная сила раствора).
Активная концентрация :
a = ![]() ∙C,
∙C,
где ![]() - коэффициент активности (пропорциональности).
- коэффициент активности (пропорциональности).
![]() зависит от ионной силы раствора и от заряда частиц.
зависит от ионной силы раствора и от заряда частиц.
Ионная сила раствора определяется концентрацией и зарядом всех ионов, находящихся в растворе.
I = 0.5∙![]()
При различном значении ионной силы раствора коэффициент активности рассчитывается:
- При I ≤ 0.05 -lg
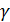 = 0.5∙Zi2
= 0.5∙Zi2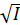
- При I ≤ 0.1 -lg
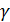 =
= 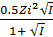
- При I ≤ 0.5 -lg
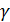 =
= 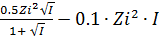
Расчет среды данного раствора.
В растворах сильных электролитов:

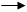 Кислоты: HCl H+
+ Cl-, pH = -lg, = Cкислоты, pH = -lgCкислоты
Кислоты: HCl H+
+ Cl-, pH = -lg, = Cкислоты, pH = -lgCкислоты
Если Cкислоты (HA) ≤ 10-5 М, т.е. раствор сильно разбавлен, в этом случае для расчета концентрации необходимо учитывать ионное произведение воды.
В таком растворе = Cкислоты + , т.к. kw = ∙; = kw/;
= Cкислоты + kw/;
2 = Cкислоты ∙ + kw;
= ![]()
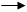
 Основания: NaOH Na+ + OH-; = Cоснования; pOH = -lg; kw = ∙ = 10-14;
Основания: NaOH Na+ + OH-; = Cоснования; pOH = -lg; kw = ∙ = 10-14;
= kw/Cоснования; pkw = pH + pOH; pH = 14 – pOH
Если раствор разбавлен (C≤10-5), то:
= kw/Cоснования;
= ![]()
В растворах слабых электролитов (органические соединения, H2CO3, H2S…, диссоциация 1-30%):

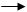 Кислоты: CH3COOH CH3COO- + H+; K = /;
Кислоты: CH3COOH CH3COO- + H+; K = /;
= Cкислоты – Cдиссоциированной кислоты; = .
Т.к. Cкислоты >>> Cдиссоциированной кислоты; K = 2/Cкислоты;
= ![]()
- Основания: kw = ∙;
= ![]()
Для слабых электролитов, у которых ![]() > 5%, а Kдис. > 10-4
концентрация рассчитывается:
> 5%, а Kдис. > 10-4
концентрация рассчитывается:
= ![]() - для кислот;
- для кислот;
= ![]() - для оснований.
- для оснований.
Поможем написать любую работу на аналогичную тему

