Описание термодинамических свойств ионов в растворах через активность и коэффициенты активности осуществляется в рамках теории Дебая-Хюккеля. В самом простейшем варианте теории будем считать все ионы точечными.
Вычислим электростатический потенциал отдельного иона в зависимости от расстояния от его центра. Для нахождения усредненного потенциала необходимо решить сферически симметричное уравнение Пуассона:
![]() (9.4)
(9.4)
где ![]() -оператор Лапласа;
-оператор Лапласа; ![]() - электростатический потенциал;
- электростатический потенциал; ![]() - плонтость зарядов на расстоянии r от центрального иона. На расстоянии r от рассматриваемого иона концентрации положительных
- плонтость зарядов на расстоянии r от центрального иона. На расстоянии r от рассматриваемого иона концентрации положительных ![]() и отрицательных
и отрицательных ![]() ионов изменяются в соответствии с законом Больцмана:
ионов изменяются в соответствии с законом Больцмана:
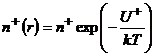 ,
, 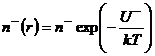 (9.5)
(9.5)
где
![]() ,
, ![]() (9.6)
(9.6)
Z – абсолютное значение заряда иона в единицах заряда электрона; n+ и n- - средние концентрации анионов и катионов. Если в растворе присутствуют ионы с разными зарядами, то для ![]() получаем
получаем
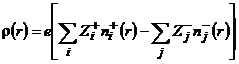 (9.7)
(9.7)
Используя уравнения (9.5) и (9.6), получаем
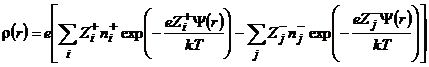 (9.8)
(9.8)
Разлагая экспоненты в выражении (9.8) в ряд и ограничиваясь в каждом разложении двумя слагаемыми, а также учитывая электронейтральность раствора
![]() (9.9)
(9.9)
получаем
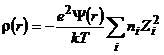 (9.10)
(9.10)
где суммирование распространено на все катионы и анионы, присутствующие в растворе. Подставляя (9.10) в (9.4), находим
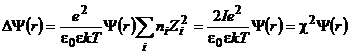 (9.11)
(9.11)
Величина I называется ионной силой раствора:
![]() (9.12)
(9.12)
Поможем написать любую работу на аналогичную тему

