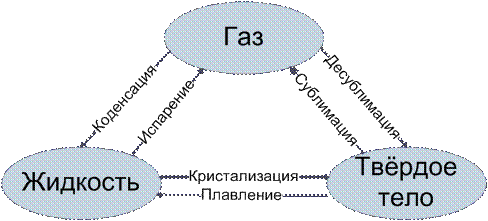
В системе, состоящей из нескольких фаз чистого вещества, находящихся в равновесии, возможны переходы вещества из одной фазы в другую. Такие переходы называются фазовыми переходами или превращениями агрегатных состояний.
![]() (18)
(18)
Уравнение (18) называется уравнением Клапейрона-Клаузиуса и является общим термодинамическим уравнением, приложимым ко всем фазовым переходам чистых веществ, т.е. к превращениям агрегатных состояний.
Фазовые переходы, характеризующиеся равенством изобарных потенциалов двух сосуществующих в равновесии фаз и скачкообразным изменением энтропии и объема при переходе вещества из одной фазы в другую,- называются фазовыми переходами первого рода. К ним относятся агрегатные превращения - плавление, испарение, возгонка и др.
Фазовый переход – переход вещества из одной температурной фазы в другую при изменении внешних условий.
Бывают:
- первого рода (скачкообразныо изменяются самые главные параметры: V, dU, )
- второго рода (p и dU=const) скачок испытывают их производные по t и p.
Правило фаз Гиббса
Число степеней свободы гетерогенной термодинамической системы, находящейся в состоянии фазового равновесия, определяется правилом фаз, сформулированным Дж. Гиббсом:
Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие.
Для системы, на которую из внешних факторов влияют только температура и давление, можно записать:
С = К – Ф + 2
Содержание этих закономерностей и составляет суть правила фаз Гиббса:
в однокомпонентной системе число степеней свободы C просто связано с числом фаз Ф, находящихся в равновесии,— C = 3 - Ф (C > 0).
в многоокомпонентной системе С = 2 + (К - 1)Ф - К(Ф - 1) = 2 - Ф + К. где К число компонентов.
Поможем написать любую работу на аналогичную тему

