Основы термодинамики адсорбции из растворов впервые сформулировал Гиббс в 70-е гг.19 в. Им было введено понятия избыточной адсорбции Г, т.е. избыточного содержания поглощаемого вещества в адсорбированной фазе по сравнению с его содержанием в растворе.
В простейших случаях, когда адсорбат не переходит в объем одной из фаз (адсорбция на твердых адсорбентах, адсорбция нелетучего компонента на границе жидкость - газ), выражение для адсорбции Гиббса запишется следующим образом:
![]() (1)
(1)
Где:
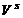 - объем поверхностного слоя;
- объем поверхностного слоя; 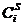 - концентрация адсорбата в поверхностном слое;
- концентрация адсорбата в поверхностном слое; - Ci - концентрация адсорбата в объеме;
- S - площадь поверхностного слоя.
Из соотношения (1) также следует, что величина гиббсовской адсорбции может быть и меньше нуля, если ![]() <
<![]() .
.
В результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностным слоем.Результатом этого процесса является изменение поверхностного натяжения.
Д.У.Гиббс вывел фундаментальное уравнение, устанавливающее связь между величиной адсорбции Г, поверхностным натяжением раствора s и равновесной концентрацией адсорбата С. Для разбавленных растворов неэлектролитов оно имеет следующий вид:
![]() (2)
(2)
Адсорбционное уравнение Гиббса записано для многокомпонентных систем и является термодинамически строгим соотношением.
Поможем написать любую работу на аналогичную тему

