Насыщенные жирные кислоты (НЖК) – углеродные цепи, у которых число атомов варьируется от 4 до 30 и больше. Насыщенные (предельные). Это жирные кислоты, молекулы которых пресыщены водородом. Они поступают в организм с колбасными изделиями, молочными, мясными продуктами, маслом, яйцами. Они участвуют в строении клеток, насыщают организм энергией.
Окислительное расщепление жирних кислот- универсальный биохимический процесс, протекающий во всех видах живих организмах. У млекопитающих этот процесс происходит во многих тканях, в первую очередь в печени, почках, сердечной и скелетной мышцах. В клетке окисление жирных кислот локализовано в матриксе митохондрий.
 Первые предположения о путях окисления жирных кислот высказал Ф.Кнооп еще в 1904 г., выдвинув свою гипотезу «
Первые предположения о путях окисления жирных кислот высказал Ф.Кнооп еще в 1904 г., выдвинув свою гипотезу «![]() -окисления», в соответствии с которой происходит последовательное отщепление двухуглеродных фрагментов CH3COOH с карбоксильного конца молекулы.Этот процесс был назван
-окисления», в соответствии с которой происходит последовательное отщепление двухуглеродных фрагментов CH3COOH с карбоксильного конца молекулы.Этот процесс был назван ![]() -окислением, поскольку каждый раз перед разрывом
-окислением, поскольку каждый раз перед разрывом ![]() происходит окисление
происходит окисление ![]() -углеродного атома по схеме:
-углеродного атома по схеме:
Природные жирные кислоты содержат четное число углеродных атомов, и любая такая кислота, отщепляя по паре углеродных атомов, в конце превращается в бутановую кислоту, которая после очередной (заключительной) стадии -окисления гидролизуется до двух молекул уксусной кислоты .В настоящее время биохимические превращения жирных кислот в процессе ![]() -окисления детально изучены. Они включают следующие основные этапы :
-окисления детально изучены. Они включают следующие основные этапы :
- активацию жирной кислоты в цитоплазме клетки;
- транспорт ацильной группы в митохондрии;
- последовательность реакции -окисления;
- энергетику окисления жирных кислот.
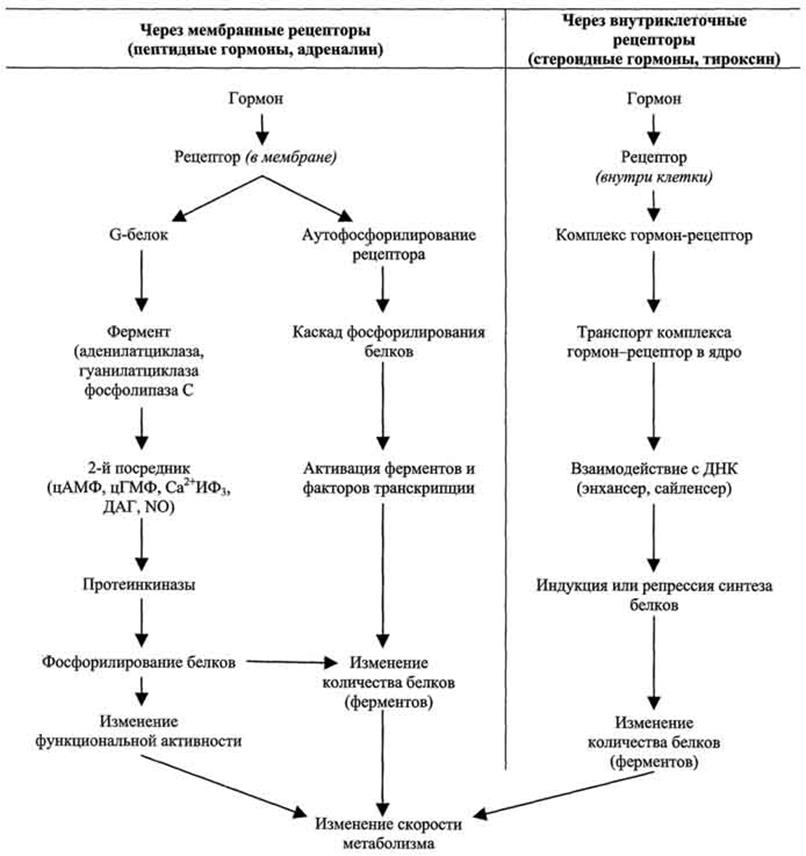
Активация жирной кислоты в цитоплазме клетки .
Реакция окисления жирной кислоты происходит только после превращения ее в активированную высокоэнергетическую форму- ацил-КоА. Этот процесс требует затраты одной молекулы АТФ, присутствия коэнзима А ионов Mg+2 ; катализирует превращение свободной жирной кислоты в активируемую форму –фермент ацил-КоА- синтетаза.В нижеприведенных реакциях он обозначен как Е* .Известен ряд тиокиназ, специфичных к жирным кислотам с разной длиной водородной цепи. Эти ферменты в клетках прокариот прикреплены к клеточной мембране , а у эукариот – к внешней мембране митохондрий.
Активизация жирной кислоты является двухстадийным процессом.
Первая стадия:
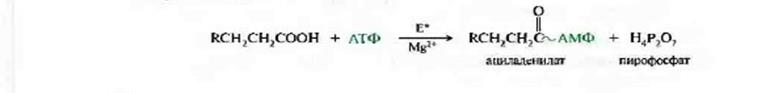
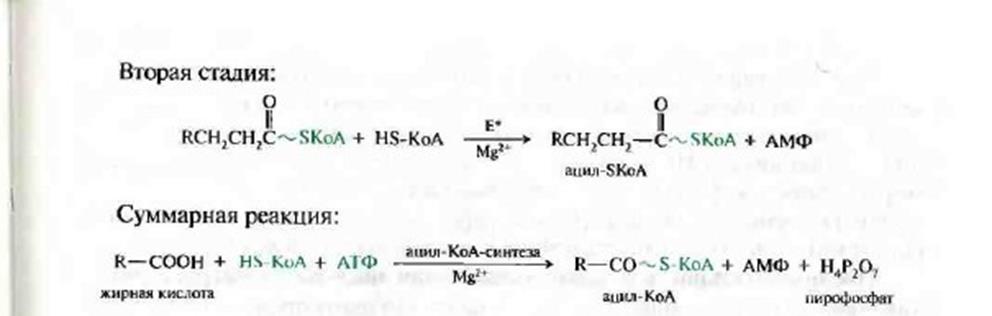 Вторая стадия:
Вторая стадия:
При действии фермента пирофосфатазы в пирофосфате расщепляется багатая энергией фосфоангидридная связь , что обеспечивает процесс активации и делает эту реакцию необратимой :
![]() H4P2O2 пирофосфатаза 2H3PO4
H4P2O2 пирофосфатаза 2H3PO4
Таким образом, для активации одной молекулы жирной кислоты расходуется две макроэргические связи АТФ.
Транспорт ацильной группы в митохондрии.
Внутрення мембрана митохондрии непроницаема для ацил-КоА, образовавшегося в цитоплазме. Переносчиком активированной жирной кислоты является карнитин. Это широко распространенное соединение, особенно много его в мышечной ткани.В транспорте ацил-КоА принимает участие фермент – карнетинацилтрансфераза и транспортный белок. Ацил-КоА, соединяясь с карнитином при действии карнитинацилтрансферазы образует ацилкарнитин , который при участии транслоказы проникает внутрь митохондрии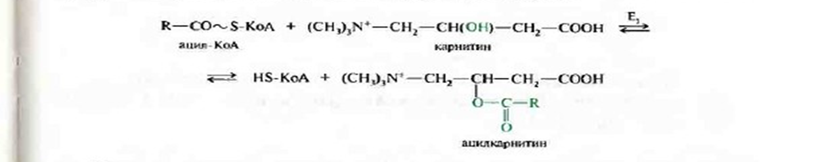
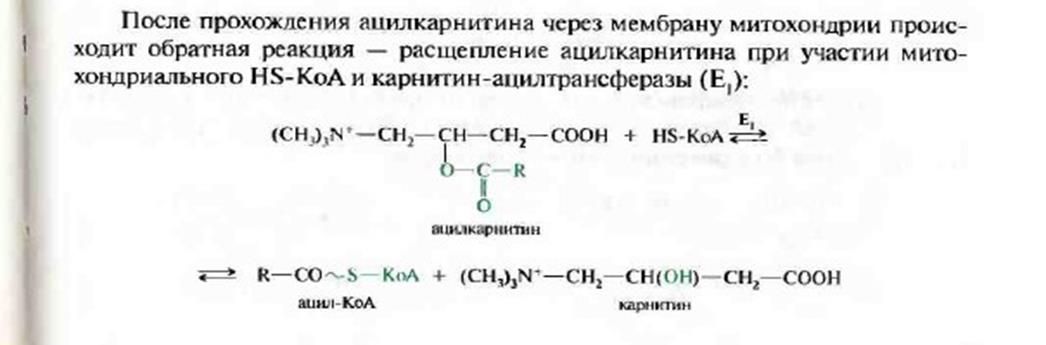
При этом карнитин возвращается в цитоплазму клетки , а ацил-КоА подвергается в митохондриях окислению. Следует отметить, что карнитин- ацилтрансфераза является основным регуляторным ферментом процесса окисления жирных кислот. Ингибитором этого фермента является исходный интермедиат синтеза жирных кислот- малонил-КоА.Таким образом, если активируется липогенез , увеличивается концентрация малонил-КоА, который ингибирует карнетин-ацил-КоА-трансферазу и выключает ![]() -окисление.
-окисление.
Последовательность реакции -окисления ацил-КоА в матриксе митохондрий.
Окисление ацил-КоА, в результате которого происходит отщепление двух углеродного фрагмента 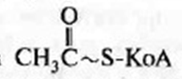 и окисления -углеродного атома кислоты , катилизируется 4 ферментами , известными под общим названием аксидазы жирных ксилот. Эта система локализована в матриксе митохондрий в непосредственной близости от дыхательной цепи, интегрированной во внутреннюю мембрану митохондрий. Таким образом, окисление ацил-КоА до ацетил-КоА, в процессе которого происходит восстановление НАД+ и ФАД, сопряжено синтезом АТФ путем окислительного фосфолирования.
и окисления -углеродного атома кислоты , катилизируется 4 ферментами , известными под общим названием аксидазы жирных ксилот. Эта система локализована в матриксе митохондрий в непосредственной близости от дыхательной цепи, интегрированной во внутреннюю мембрану митохондрий. Таким образом, окисление ацил-КоА до ацетил-КоА, в процессе которого происходит восстановление НАД+ и ФАД, сопряжено синтезом АТФ путем окислительного фосфолирования.
1.Реакция дегидрирования, катализируемая ФАД- зависимой ацил-КоА дегидрогеназой, приводит к образованию ![]() ,
,![]() - ненасыщенного ацил-SКоА. Фермент обладает стериоспецифичностью, поэтому в результате этой реакции образуется только транс-изомер
- ненасыщенного ацил-SКоА. Фермент обладает стериоспецифичностью, поэтому в результате этой реакции образуется только транс-изомер
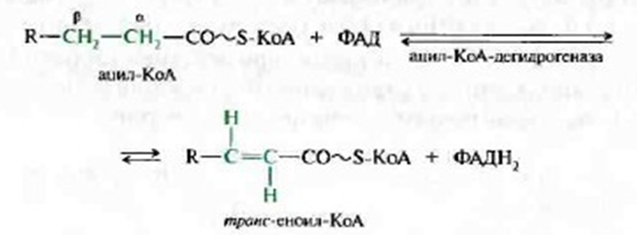
2.Во второй реакции происходит гидратация ненасыщенного транс-еноил-КоА при действии фермента еноил-КоА-гидратазы. В результате образуется L-![]() -гидроксиацил-КоА:
-гидроксиацил-КоА:

3.Реакция дегидрирования , в процессе которой образовавшийся ![]() -гидроксиацил-КоА дегидрируется в
-гидроксиацил-КоА дегидрируется в ![]() -положение .Эту реакцию катализирует НАД –зависимая
-положение .Эту реакцию катализирует НАД –зависимая ![]() -гидроксиацил-КоА-дегидрогеназа:
-гидроксиацил-КоА-дегидрогеназа:
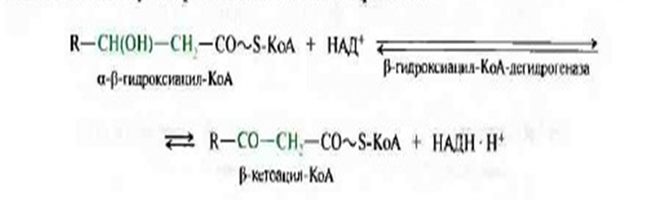
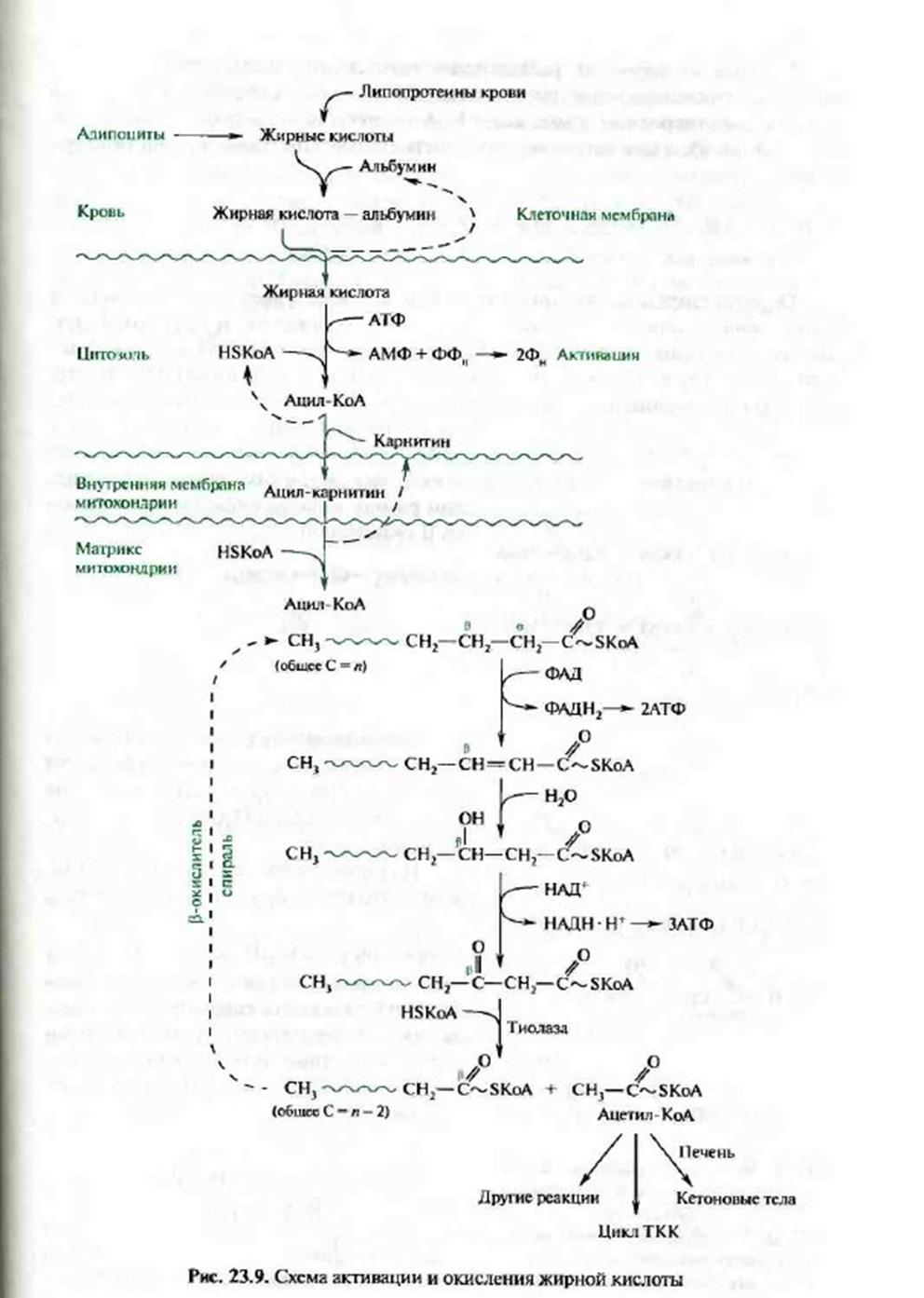
В заключительной реакции тиолитического расщепления ![]() -кетоацил-КоА с помощью еще одной молекулы коензима А образуется укороченный на два углеродных атома ацил-КоА и двухуглеродный фрагмент в виде ацетил-КоА.Реакция катализируется ацетил-КоА-ацилтрансферазой:
-кетоацил-КоА с помощью еще одной молекулы коензима А образуется укороченный на два углеродных атома ацил-КоА и двухуглеродный фрагмент в виде ацетил-КоА.Реакция катализируется ацетил-КоА-ацилтрансферазой:
КоА.Реакция катализируется ацетил-КоА-ацилтрансферазой:

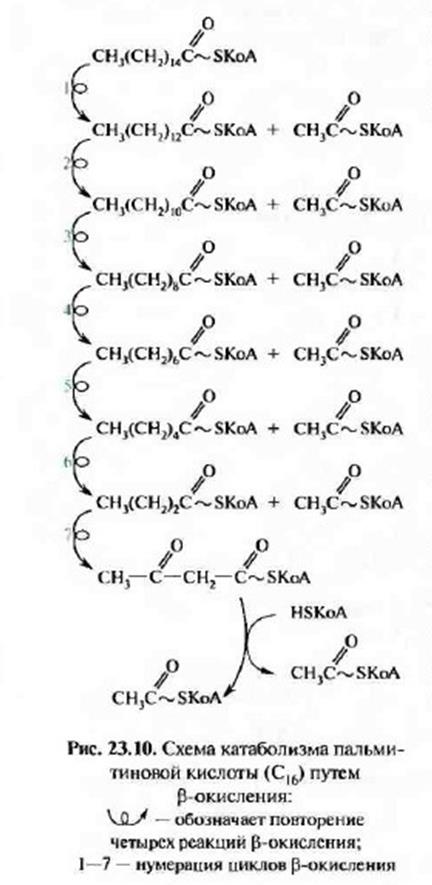 Образующийся укороченый ацил-КоА вновь вступает в следующий цикл
Образующийся укороченый ацил-КоА вновь вступает в следующий цикл ![]() -окисления, начиная с первой реакции дегидрирования, и происходит повторное превращение этого ацил-КоА в цикле, состоящим из 4 реакций, и т.д.Такой процесс
-окисления, начиная с первой реакции дегидрирования, и происходит повторное превращение этого ацил-КоА в цикле, состоящим из 4 реакций, и т.д.Такой процесс ![]() -окисления протекает до образования 4-х углеродного соединения – ацетоацетил-КоА.Последння реакция тиолитического расщепления этого соединения приводит к образованию двух молекул ацетил-КоА и тем самым завершает в целом распад жирной кислоты по механизму -окисления:
-окисления протекает до образования 4-х углеродного соединения – ацетоацетил-КоА.Последння реакция тиолитического расщепления этого соединения приводит к образованию двух молекул ацетил-КоА и тем самым завершает в целом распад жирной кислоты по механизму -окисления: 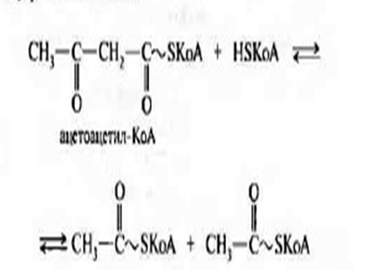
Как отмечалось ранее , молекулы ацетил-КоА, образовавшиеся из жирной кислоты, подвергаются полному окислению до СО2 и Н2О в цикле трикарбоновых кислот.

Катаболизм безазотистых остатков аминокислот.Синтез аминокислот.
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи.
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез .Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании.
Гликогенные и кетонные аминокислоты
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в
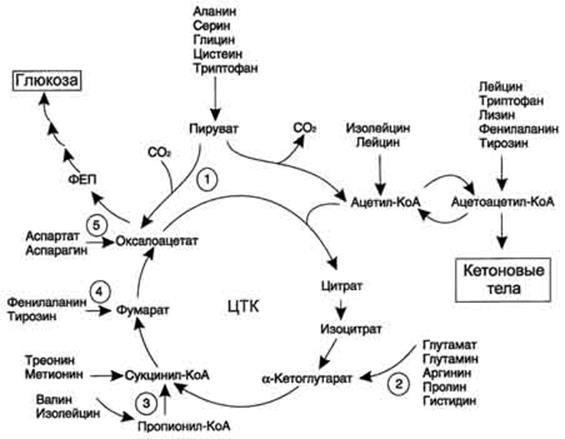
процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными
Таблица 9-5. Классификация аминокислот по судьбе безазотистого остатка
|
Гликогенные |
Гликокетогенные |
Кетогенные |
|
Алании |
Тирозин |
Лейцин |
|
Аспарагин |
Изолейцин |
Лизин |
|
Аспартат |
Фенилаланин |
|
|
Глицин |
Триптофан |
|
|
Глутамат |
|
|
|
Глутамин |
|
|
|
Пролин |
|
|
|
Серии |
|
|
|
Цистеин |
|
|
|
Аргинин |
|
|
|
Гистидин |
|
|
|
Валин |
|
|
|
Метионин |
|
|
|
Треонин |
|
|
Анаплеротические реакции
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке 9-22 выделены пять анаплеротических реакций:
1. ![]()
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 - основные анаплеротические реакции.
Синтез аминокислот.
Получение аминокислот в промышленных условиях осуществляется посредством химического или микробиологического синтеза.
Химический синтез.
Химический синтез поливариантен, однако во всех случаях связен с получением рацемических смесей, которые затем необходимо разделять на оптически активные стериоизомеры. Синтез, предложенный в 20 в. А.Штреккером , основан на реакции альдегида R-CHO с цианидом калия и мочевиной. Полученная циклическая производная аминокислоты гидролизуется щелочью с образованием рацемической смеси D, L – аминокислоты. В качестве примера можно привести получение L-метионина из -метилтиопропионового альдегида, который, в свою очередь, синтезируется из акролеина и метилмеркаптана:
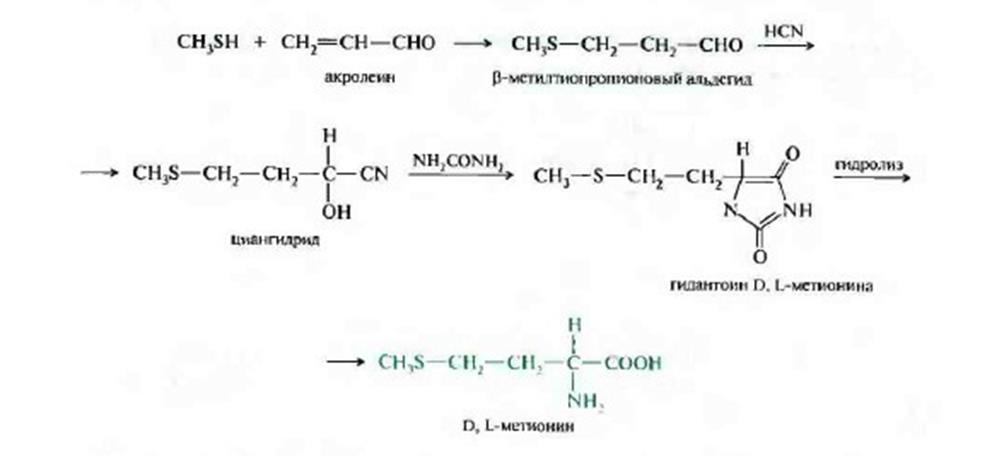
Так как в пищевой промышленности и медицине применяют только L- изомеры аминокислот, рацемические смеси необходимо разделять на отдельные энантиомеры.Для этой цели используют различные хроматографические методы, в том числе и основанные на ионном обмене. Химические методы разделения , связанные с взаимодействием рацематов с определенными асимметрическими соединениями, достаточно сложны и не находят применения в промышленных условиях. Гораздо более эффективным является ферментативный метод разделения рацематов аминокислот, в первые разработанный и использованный японскими исследователями.В основу метода положена способность фермента ацилазы L- аминокислот специфически гидролизировать только ацилированные L- аминокислоты без воздействия на D-стериоизомеры.Ацелированные аминокислоты, полученные методом химического синтеза подвергаются воздействию иммобилизированного фермента ацилазы, при чем после полного ферментативного гидролиза образуется смесь ацилированной D-аминокислоты и свободного L-стериоизомера, легко разделяющиеся простой кристаллизации или посредством ионообменной хроматографии.
Если оставшуюся ацил- D-аминокислоту подвергнуть нагреванию то можно снова получить рацемическую смесь , из которой затем извлекается свободная L-аминокислота.
Таким образом, при использовании иммобилизованной аминоацилазы можно данный процесс проводить многократно и получать свободные L-аминокислоты с максимальным выходом.Оказалось что сродство фермента к ацилированным аминокислотам примерно одинаково и определяется не строением аминокислоты как таковой , а исключительно ацильной группировкой.Иммобилизованная на смоле аминоацелаза достаточно стабильна; период ее полуинактивации в промышленных условиях находится в пределах двух месяцев.
Ферментативный синтез.
В результате ферментативного синтеза образуется в основном L-аминокислоты. Примером может служить широко распространенный в промышленности синтез L-аспарагиновой кислоты из фумаровой кислоты и аммиака под действием фермента аспартазы:
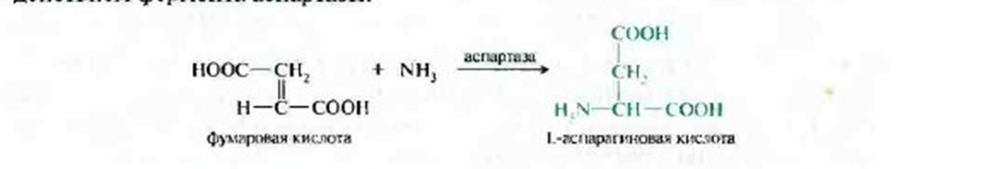
Одним из существенных преимуществ данного процесса, имеющего большое значение для промышленного производства, является то, что он протекает в одну стадию и обеспечивает получение только L-стериоизомеров аспарагиновой аминокислоты.
Получение L-фенилаланина из коричной кислоты и аммиака осуществляется при помощи фермента фенилаланин-аммиак-леазы также в одну стадию:
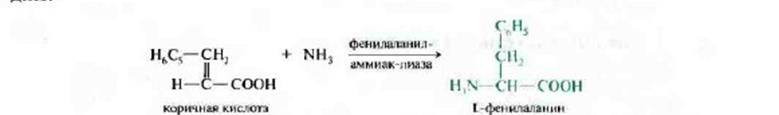
Микробиологический синтез
Многие микроорганизмы синтезируют свободные аминокислоты , имеющие промышленное значение. Пути биосинтеза отдельных аминокислот получили свое развитие в результате внедрения в практику ауксотрофных мутантов и применения радиоизотопных методов.
Используют мутанты микроорганизмов , которые утратили некоторые ферменты синтеза одних аминокислот; но приобрели способность интенсивно синтезировать другие. Ауксотрофные мутанты отбирают на селективных средах после воздействия на бактериальные клетки ультрафиолетовым или рентгеновским излучением или за счет химического мутагенеза.
Одной из первых аминокислот , полученных из коринебактерий методом микробиологического синтеза в промышленных условиях, была L-глутаминовая аминокислота . Усиление синтеза этой аминокислоты подавляет ее дальнейшее образование по принципу обратной связи, поэтому целесообразно в питательную среду вводить поверхностно-активные вещества и жирные кислоты для увеличения проницаемости клеточных мембран и елиминации глутаминовой кислоты из клетки.
Из коринебактерий можно получать также ароматические аминокислоты, например триптофан.
Поможем написать любую работу на аналогичную тему

