Впервые этот метод был апробирован путем инъекции SV40 (Simian vacuolating virus 40) ДНК в бластоцисты мыши (Jaenisch, Mintz, 1974). Рожденное потомство было, конечно, химерным, т.е. клетки не всех тканей содержали вирусную ДНК, поскольку не все клетки бластоцисты были трансфицированы. Трансгенные мыши были получены, когда ДНК (клонированный про вирус Молони) была инъецирована в цитоплазму зиготы (Harbers et al., 1981). Уже в то время было обнаружено, что характер экспрессии введенных вирусных геномов зависит от места их интеграции в клеточные хромосомы. В одних линиях трансгенных мышей продукции вируса начиналась в клетках печени еще на стадии плода, в других — в селезенке, вскоре после рождения. Имелись также линии, в которых вирусы не продуцировались совсем, несмотря на присутствие провируса.
Подобная временная и тканевая специфичность экспрессии была выявлена и у трансгенных мышей, несущих индивидуальные чужеродные гены (Gordon, Huddle, 1981). Эти авторы инъецировали клонированные гены ТК+ вируса простого герпеса и β-глобина человека ДНК в мужской пронуклеус (он больше по размеру) только что оплодотворенных in vitro яйцеклеток, что оказалось более эффективным способом, чем инъекция в цитоплазму. Обработанные клетки сначала культивируют in vitro до стадии морулы или бластоцисты, а затем имплантируют “приемным” матерям. До 40 % родившегося потомства является трансгенным .
Как показали результаты опытов, интеграция чужДНК происходит в различные сайты разных хромосом, и поэтому нельзя предсказать характер экспрессии чужеродных генов. Однако во многих случаях экспрессией можно управлять, если гены присоединять к индуцибельным промоторам. Так, ген ТК+ был поставлен под контроль промотора гена металлотионина-1 (МТ) мыши. Этот белок участвует в рефляции обмена цинка и связывает ионы тяжелых металлов. Поэтому с помощью цинка и кадмия удаюсь индуцировать экспрессию гена ТК+ в разных тканях полученных трансгенных мышей, причем тканеспецифичность экспрессии соответствовала той, которую проявляет сам ген МТ. Число копий гена в клетке у разных особей варьировало от 1 до 150. Трансгенные мыши передавали ген ТК+ своему потомству, но количественно характер экспрессии у разных потомков был различным.
Аналогичным образом была осуществлена регуляция экспрессии геномного гена гормона роста крысы (GH), помещенного в плазмиде pMGH под промотор гена МТ и сохранившего свой сайт полиаденилирования (рис. 1.1.1). Фрагмент рекомбинантной плазмиды с экспрессионной кассетой был инъецирован в мужской пронуклеус 170 оплодотворенных яйцеклеток мыши. 21 мышь дала потомство. Треть потомства содержала гены GH, число которых в клетках разных линий мышей изменялось от I до 35. Пропорционально менялась и концентрация самого гормона, причем в данном случае его синтез слабо зависел от добавляемого в пищу цинка. Избыточное количество гормона способствовало развитию гигантизма: наиболее крупные особи были тяжелее нормальных животных почти в два раза (Palmiter et eft., 1982).
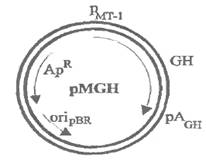
Рис 1.1.1. Рекомбинантная плазмида рМGН, несущая ген гормона роста GH крысы под контролем промотора гена металлотионина-1.
Рмт — промотор гена металлотионина-1; рАGH — сайт полиаденилирования гена гормона роста
Данный гормон секретируется. Его концентрация в плазме крови превышала в 100—1000 раз его нормальное содержание в плазме крови трансгенных животных и была много выше, чем в клеточных культурах, сконструированных для производства того же гормона. Поэтому был поднят вопрос о возможно большей экономичности технологии получения генно-инженерных продуктов от животных-доноров, чем от клеточных (бактериальных или животных) технологий. Описанная работа способствовала многочисленным попыткам применить этот метод для увеличения веса животных, надоев молока и т.п.
Метод микроинъекции ДНК в цитоплазму оплодотворенных яйцеклеток оказался единственным эффективным способом получения трансгенных рыб. Наибольшее число попыток связано с введением геномных генов или кДНК гормонов роста человека и форели. Во многих случаях было показано, что гетерологичные гены интегрируются в клеточную ДНК, передаются потомству и экспрессируются, приводя к ускоренному развитию рыб и увеличению их веса .
Поможем написать любую работу на аналогичную тему

