Кровь – жидкая подвижная ткань, перемещающаяся по сосудам. Выполняет роль транспортного и коммуникативного средства, интегрирующего обмен веществ в различных органах и тканях в единую систему.
Общая характеристика
Общий объем крови у взрослого человека составляет у женщин – 4 л, у мужчин – 5,2 л (примерно 8 % от массы тела). В норме рН крови – 7,36 – 7,7. Относительная плотность цельной крови – 1,050 – 1,065, плазмы – 1,024 – 1,030. Вязкость крови в 4-5 раз выше вязкости воды благодаря высокому содержанию белка и эритроцитов. Осмотическое давление плазмы крови при температуре 37о ~ 7,6 атм.
Функции крови
Кровь осуществляет транспорт различных химических веществ по кровеносным сосудам.
1. Дыхательная функция – перенос кислорода из легких в ткани и СО2 из тканей в легкие.
2. Трофическая функция – транспорт питательных веществ: глюкозы и кетоновых тел, липидов, жирных кислот, аминокислот и т.д.
3. Выделительная функция – транспорт конечных продуктов обмена из тканей в выделительные органы: мочевины из печени в почки, билирубина из тканей в печень.
4. Регуляторная функция – транспорт сигнальных молекул (гормонов, регуляторных пептидов и др.) от органов внутренней секреции к тканям-мишеням.
5. Защитная функция – обусловлена следующими факторами:
- клеточные (лейкоциты, лимфоциты, макрофаги) и гуморальные (антитела) элементы иммунной защиты;
- факторы свертывания крови.
6. Регуляция осмоса – белки крови поддерживают коллоидно-осмотическое давление и тем самым обеспечивают постоянный объем крови.
7. Регуляция рН (кислотно-основного равновесия).
Кислотно-основное равновесие обеспечивается буферными системами крови:
а) бикарбонатная (на её долю приходится ~ 10% всей буферной емкости крови) представлена сопряженной кислотно-основной парой, состоящей из молекул угольной кислоты Н2СO3 (донор протона) и бикарбонат-иона НСО3- (акцептор протона).
б) фосфатная (составляет 1% буферной емкости крови) сопряженная кислотно-основная пара: ион Н2РО4- (донор Н+) и ион НРО42- (акцептор Н+).
в) гемоглобиновая самая мощная система – обеспечивает 75% буферной емкости крови, состоит из неионизированного оксиНв (ННвО2) и калиевой соли оксиНв (КНвО2).
г) белковая имеет меньшее значение;
белки образуют буферные системы благодаря наличию кислотно-основных групп в молекуле.
8. Терморегуляторная функция – кровь поддерживает постоянство температуры тела в разных его частях.
Особенности метаболизма в форменных элементах крови
Эритроциты:
1. Зрелые эритроциты лишены ядра, поэтому в клетке не синтезируются белки. Эритроцит почти целиком заполнен гемоглобином.
2. Эритроциты не имеют митохондрий, поэтому в клетке не протекают реакции ЦТК, ЦТД, β-окисления жирных кислот.
3. Основной путь получения энергии – гликолиз, 90% глюкозы в эритроцитах распадается в процессе анаэробного гликолиза.
4. Энергия, поставляемая гликолизом, обеспечивает поддержание целостности плазматической мембраны и работу Na+, K+-АТФазы.
5. Особенностью гликолиза в эритроцитах является наличие шунта, приводящего к образованию 2,3-дифосфоглицерата – одного из регуляторов переноса кислорода. При связывании его с гемоглобином уменьшается сродство гемоглобина к кислороду и облегчается освобождение кислорода из эритроцитов в тканях.
Реакция образования 2,3-дифосфоглицерата, отсутствующая в «классическом» гликолизе, называется шунт Раппопорта.
6. 10 % глюкозы распадается в эритроците в пентозофосфатном пути. Образующийся при этом НАДФН обеспечивает восстановление глутатиона и поддерживает его оптимальную концентрацию. Восстановленный глутатион необходим для поддержания в восстановленной форме SH-групп белков; препятствует окислению гемоглобина; предотвращает перекисное окисление липидов мембран. При снижении концентрации восстановленного глутатиона эритроцит быстро «стареет».
Лейкоциты:
1. Лейкоциты являются полноценными клетками с большим ядром, митохондриями и высоким содержанием нуклеиновых кислот.
2. В лейкоцитах активно протекают процессы биосинтеза нуклеиновых кислот и белков.
3. Основной путь получения энергии – аэробный гликолиз. АТФ образуется также в реакциях β-окисления жирных кислот.
4. В лейкоцитах сосредоточен весь гликоген крови, который является источником энергии при недостаточном её поступлении.
5. В лизосомах лейкоцитов локализована мощная система протеолитических ферментов – протеазы, фосфатазы, эстеразы, ДНК-азы, РНК-азы, что обеспечивает участие этих клеток в защитных реакциях организма. В результате действия этих ферментов разрушаются полимерные молекулы микроорганизмов и образуются мономеры (моносахариды, аминокислоты, нуклеотиды), которые поступают в цитозоль и могут использоваться клеткой.
6. Поглощение бактерий лейкоцитами в процессе фагоцитоза сопровождаются резким увеличением потребления кислорода с образованием супероксидного аниона и пероксида водорода (см. лекцию № 11), которые оказывают бактерицидное действие. Это явление называется «распираторным взрывом».
Лимфоциты.
Продуцируются в лимфатической ткани. Интенсивный синтез белков и γ-глобулинов в этих клетках обуславливает важную роль лимфоцитов в иммунных процессах (образование антител).
Тромбоциты – кровяные пластинки.
1. Тромбоциты не могут считаться полноценными клетками, поскольку не содержат ядра.
2. В тромбоцитах протекают основные биохимические процессы: синтез белка, реакции обмена углеводов и липидов, окислительное фосфорилирование.
3. Основная функция тромбоцитов – участие в процессе свертывания кровиобусловлена наличием тромбоцитарных факторов свертывания.
Гемоглобин человека
Гемоглобин – сложный железосодержащий белок, относится к классу гемопротеинов. Выполняет две важные функции:
- перенос кислорода из легких к периферическим тканям;
- участие в переносе СО2 и протонов из периферических тканей в легкие.
Производные гемоглобина
Молекула гемоглобина взаимодействует с различными лигандами, образуя производные гемоглобина.
1. Дезоксигемоглобин – ННb – не связанный с кислородом и содержащий гем с двухвалетным железом Fe2+.
2. Оксигемоглобин – ННbO2 – полностью оксигенированный гемоглобин, связанный с четырьмя молекулами кислорода.
3. Карбгемоглобин – ННbCO2 – гемоглобин, связанный с СО2. Выполняет функцию выведения СО2 из тканей к легким. Соединение нестойкое, легко диссоциирует в легочных капиллярах. Этим путем выводится до 10-15% СО2.
4. Карбоксигемоглобин – ННbСО – образуется при отравлении оксидом углерода (II). Сродство гемоглобина к СО примерно в 300 раз выше, чем к кислороду, при этом гемоглобин теряет способность связывать кислород и наступает смерть от удушья.
5. Метгемоглобин – MetHb – образуется при действии окислителей (нитрит натрия, нитробензол). Содержит железо в трехвалентной форме Fe3+ и теряет способность к переносу кислорода. В норме образуется небольшое количество метгемоглобина – примерно 0,5 % в сутки.
Варианты гемоглобина в онтогенезе
Количество и состав фракций гемоглобина изменяется в процессе онтогенеза. Все гемоглобины представляют собой тетрамеры, построенные из разного набора субъединиц (α, β, γ, δ) и преимущественно образуются на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различают следующие физиологические типы гемоглобинов: примитивный гемоглобин НbР, фетальный гемоглобин HbF (fetus – плод), гемоглобин взрослых HbA, HbA2, HbA3 (adultus – взрослый).
Примитивный гемоглобин – синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Состоит из двух α- и двух ε-цепей (2α, 2ε). Через две недели после формирования печени плода в ней начинает синтезироваться HbF, который к шести месяцам полностью замещает НbР.
Фетальный гемоглобин – синтезируется в печени и костном мозге плода до периода его рождения. Состоит из двух α- и двух γ-цепей (2α, 2γ). Характеризуется более высоким сродством к кислороду и обеспечивает эффективную доставку кислорода к эмбриону из системы кровообращения матери. HbF является главным типом гемоглобина плода. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на HbA. В крови взрослого человека присутствует в минимальном количестве – до 1,5% от общего количества гемоглобина.
Гемоглобин А – основной гемоглобин взрослого человека (96 % от общего количества). Начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода. HbA состоит из двух α- и двух β-цепей.
Минорные гемоглобины:
1) HbA2 - 2α 2δ, в крови взрослого человека примерно 2,6 % HbA2. Обладает большим сродством к кислороду.
2) HbA3 - 2α 2β, однако имеются изменения в строении β-цепей по сравнению с HbA. Появляется в крови в небольших количествах при старении.
Гемоглобинопатии
Все структурные аномалии белковой части гемоглобина называют гемоглобинозами. Различают:
- гемоглобинопатии;
- талассемии.
Гемоглобинопатии – наследственные изменения структуры какой-либо цепи нормального гемоглобина вследствие точечных мутаций генов. Известно около 300 вариантов HbA, имеющих в первичной структуре α- или β-цепи незначительные изменения. Некоторые из них практически не влияют на функции белка и здоровье человека, другие – вызывают значительные нарушения функции HbA и развитие заболеваний различной степени тяжести.
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
- находящиеся на поверхности белка;
- участвующие в формировании активного центра;
- аминокислоты, замена которых нарушает трехмерную конформацию молекулы;
- аминокислоты, замена которых изменяет четвертичную структуру белка и его регуляторные свойства.
Аномальные гемоглобины отличаются от HbA по первичной структуре, форме, величине заряда. При этом изменяются такие свойства как сродство к кислороду, растворимость, устойчивость к денатурации и др.
Примеры.
1. Серповидноклеточная анемия. Наследственное заболевание, связанное с заменой глутаминовой кислоты в 6-м положении (с N-конца) на валин в β-цепях молекулы гемоглобина S. Растворимость дезоксигемоглобина S значительно снижена. Его молекулы начинают «слипаться», образуя волокнистый осадок, который деформирует эритроцит, придавая ему форму серпа (полумесяца). Такие эритроциты плохо проходят через капилляры тканей, закупоривают сосуды и создают локальную гипоксию. Они быстро разрушаются и возникает гемолитическая анемия. Дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте. Болезнь распространена в странах Южной Америки, Африки и Юго-Восточной Азии.
2. Гемоглобин М – в результате мутации в гене происходит замена в α- или β-цепи гистидина (в 7-м или 8-м положении) на тирозин. В результате этого Fe2+ окисляется в Fe3+ и образуется метгемоглобин, не способный связывать кислород. Развивается цианоз и гипоксия тканей.
Талассемии – наследственные заболевания, связанные с нарушением синтеза α- или β-цепей.
β-талассемии развиваются в результате снижения синтеза β-цепей. Проявляется после рождения, при этом в крови наряду с НbА появляется до 15 % НbА2 и 15-60 % HbF. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки и сопровождается гемолитической анемией.
α-талассемии возникают при нарушении синтеза α-цепей. При полном отсутствии α-цепей наступает внутриутробная гибель плода, так как не образуется HbF, а тетрамеры γ4 обладают высоким сродством к кислороду и не способны выполнять транспортную функцию, что ведет к развитию тканевой гипоксии и к смерти вскоре после рождения.
Обмен железа
В организме взрослого человека содержится 3-4 г железа, из этого количества около 3,5 г находится в плазме крови. Гемоглобин эритроцитов содержит примерно 68 % всего железа организма, ферритин – 27 % (резервное железо печени, селезенки, костного мозга), миоглобин (в мышцах) – 4 %, трансферрин (в плазме крови) – 0,1. На долю всех содержащих железо ферментов приходится примерно 1 % железа, имеющегося в организме.
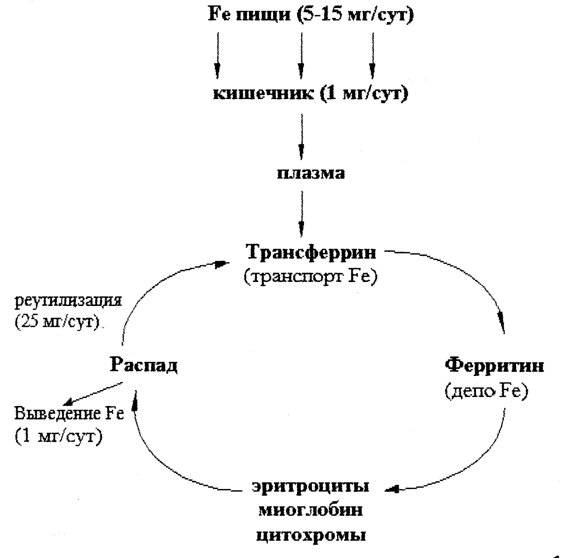
Рис. 30.1. Обмен железа в организме человека.
В обмене железа принимает участие ряд белков.
Апоферритин. Белок связывает железо в эритроцитах и превращается в ферритин, который остается в энтероцитах. Таким способом регулируется поступление железа в капилляры крови из клеток кишечника. Когда потребность организма в железе невелика, скорость синтеза апоферритина повышается. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется.
Трансферрин. Это транспортный белок, относится к гликопротеинам, синтезируется в печени. Он имеет два центра связывания железа. Трансферрин транспортирует железо с током крови к местам депонирования и использования. В норме трансферрин насыщен железом приблизительно на 33 %.
Ферритин. Олигомерный белок с молекулярной массой 450 к Да. Он состоит из 24 идентичных протомеров, образующих полую сферу. Железо депонируется в ферритине в виде гидроксифосфата. Содержание железа в молекуле ферритина непостоянно. Функция ферритина – депонирование железа. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезенке, костном мозге.
Железодефицитные анемии
Железодефицитные анемии развиваются в результате нарушения обмена железа. Встречаются чаще других форм анемий.
Основные причины:
- хронические кровопотери;
- нарушения всасывания железа в ЖКТ (язвы, опухоли после операций на ЖКТ);
- повышенная потребность организма в железе (при беременности, у детей);
- недостаток железа в пище (как правило у детей, получающих мало мясной пищи).
Характерные признаки железодефицитных анемий:
- понижение концентрации гемоглобина (в единице объема крови) и числа эритроцитов в периферической крови;
- снижение уровня сывороточного железа;
- снижение насыщения трансферрина железом;
- снижение концентрации ферритина;
- повышение железосвязывающей способности сыворотки крови.
Железодефицитные анемии сопровождаются задержкой роста и развития (у детей), слабостью, снижением работоспособности, восприимчивостью к инфекциям.
Белки плазмы крови
Из 10 % сухого остатка плазмы крови на долю белков приходится около 7 %. Плазма крови, лишенная фибриногена, называется сывороткой. Содержание белков в сыворотке крови в норме составляет 65-85 г/л.
Белки плазмы крови выполняют множество функций.
1. Транспортная (альбумины, трансферрин, транскортин и др.).
2. Защитная:
- белки системы свертывания крови способствуют сохранению постоянного количества крови в сосудистом русле при повреждениях;
- γ-глобулины обеспечивают иммунную защиту;
- белки системы комплемента.
3. Поддержание онкотического (коллоидно-осмотического) давления крови (альбумины).
4. Регуляция кислотно-основного равновесия (белковая буферная система).
5. Белки плазмы крови являются резервом аминокислот для организма.
Характеристика белков сыворотки крови
Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью. Продукты протеолиза обладают высокой биологической активностью.
Биороль белков системы комплемента:
- защитная функция, обеспечивают лизис бактериальных клеток;
- регуляция проницаемости и тонуса сосудов;
- обеспечивают хемотаксис клеток;
- обеспечивают взаимодействие между клетками (реакции агрегации тромбоцитов).
Существует два пути активации белков системы комплемента:
- классический – инициируется иммуноглобулинами и их комплексами с антигенами;
- альтернативный – инициируется микробными полисахаридами и липополисахаридами бактериальных клеток.
Белки кининовой системы – кинины, биологически активные пептиды, сходные по происхождению, строению и биологическим свойствам. К ним относятся брадикинин и каллидин. Кинины образуются в тканях и в крови из неактивных белков-предшественников кининогенов, которые синтезируются в печени. Кининогены подвергаются ферментативному расщеплению под действием калликреинов, которые имеются в плазме, клетках крови и во многих органах. Тканевые калликреины освобождают из кининогенов каллидин (10 аминокислотных остатков), а плазменные калликреины – брадикинин (9 аминокислотных остатков).
Биороль белков кининовой системы:
- расслабляют гладкие мышцы кровеносных сосудов (сосудорасширяющее действие);
- снижают артериальное давление;
- повышают проницаемость капилляров;
- стимулируют сокращения сердца;
- вызывают сокращение гладких мышц бронхов, матки, кишечника;
- раздражают болевые рецепторы;
- участвуют в развитии воспалительных реакций.
Белки-ингибиторы протеолиза – способны ингибировать трипсин и другие протеолитические ферменты. Основной представитель α1-антитрипсин. Содержание в норме 2,5 – 4 г/л, при воспалительных процессах в организме их содержание увеличивается до 5 – 7 г/л. Эти белки освобождаются из лизосом при разрушении бактериальных клеток и обеспечивают минимальное повреждение тканей.
Белки острой фазы. Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах – полипептид интерлейкин, освобождающийся из мононуклеарных фагоцитов.
К белкам острой фазы относят С-реактивный белок, гаптоглобин, кислый гликопротеин, α1-антитрипсин (см. выше), фибриноген.
С-реактивный белок, соединяясь с бактериальными полисахаридами или фосфолипидами поврежденных тканей, может активировать систему комплемента. В сыворотке крови здорового организма С-реактивный белок отсутствует, но обнаруживается при многих патологических состояниях, сопровождающихся воспалением и некрозом тканей в острой период болезни. Так, при обострении ревматоидного артрита его концентрация может возрастать в 30 раз по сравнению с нормой. С переходом в хроническую фазу заболевания С-реактивный белок исчезает из крови.
Гаптоглобин составляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Гаптоглобин также относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях. Например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии.
Патологии системы свертывания крови.
Гемофилии
Гемофилин – наследственные заболевания, обусловленные отсутствием определенных факторов свертывания крови. Гемофилия А связана с дефицитом фактора VIII, гемофилия В (болезнь Кристмаса) – фактора IX, гемофилия С – фактора XI. Наиболее часто встречается гемофилия А. Ген фактора VIII локализован в X-хромосоме. Повреждение этого гена проявляется как рецессивный признак, поэтому у женщин, в геноме которых две Х-хромосомы, гемофилии А не бывает. Заболевание может проявляться сразу после рождения и только у лиц мужского пола. Характерные признаки заболевания: медленное заживление пупочной ранки и кровотечения из нее в первые три недели жизни, кровоизлияния в мозг и мозговые оболочки в течение первого года жизни, подкожные, внутрисуставные кровоизлияния, желудочно-кишечные и спонтанные кровотечения. Частая потеря крови приводит к развитию железодефицитной анемии.
Диссеминированное внутрисосудистое свертывание
(ДВС-синдром)
ДВС-синдром представляет собой общепатологический процесс, вызванный проникновением в кровоток активаторов свертывания крови и агрегации тромбоцитов. Это приводит к одновременной активации и последующему истощению системы свертывания крови и фибринолитической системы. Вследствие этой активации образуется тромбин (в капиллярах возникают мелкие тромбы за счет полимеризации фибрина) и плазмин, гидролизующий фибриноген. Коагуляция (процессы тромбообразования) сопровождается геморрагическими явлениями (обильными кровотечениями).
Причины возникновения ДВС-синдрома разнообразны: инфекции, гипоксия, ацидоз, тяжелые травмы, деструкция тканей, новообразования, иммунные заболевания, аллергические реакции, лечение препаратами, вызывающими агрегацию тромбоцитов, антикоагулянтами и фибринолитиками.
Поможем написать любую работу на аналогичную тему

