Структура и функции ферментов, а также механизм их действия почти ежегодно подробно обсуждаются на многих международных симпозиумах и конгрессах. Важное место отводится рассмотрению структуры всей молекулы фермента и ее активных центров, молекулярному механизму действия различных типов ферментов, общей теории энзиматического катализа. Тем не менее, до сих пор нет полной ясности по двум кардинальным проблемам энзимологии: чем вызваны специфичность действия и высокая каталитическая эффективность ферментов?
После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих в реакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента.
Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Это можно схематически проиллюстрировать следующими примерами:
![]()
На рис. 13 представлена схема образования промежуточного фермент-субстратного комплекса. Если фермент в активном центре содержит кофермент, то предполагается образование тройного комплекса (рис. 14).
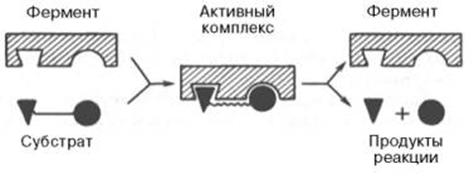
Рисунок 13 - Образование нестойкого фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок»
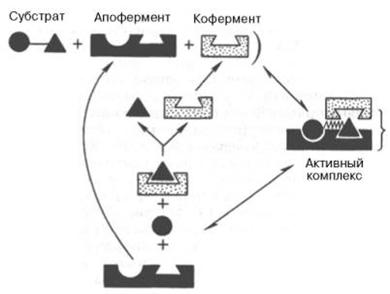
Рисунок 14 - Функция кофермента (по А. Кантарову и Б. Шепартцу)
Фермент вступает во взаимодействие с субстратом на очень короткий период, поэтому долгое время не удавалось показать образование такого комплекса. Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статической механики химических реакций позволяют определить для ряда
ферментативных реакций кинетические и термодинамические показатели, в частности константы диссоциации промежуточных фермент-субстратных комплексов, константы скорости и равновесия их образования.
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи.
Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Этим изменениям придается большое значение в некоторых теориях ферментативного катализа. Так, в противоположность модели Э. Фишера «ключ-замок» Д. Кошлендом была разработана теория «индуцированного соответствия». На рис. 15 видно, что присоединение субстрата S к ферменту Е, вызывая соответствующие изменения конформации активного центра, в одних случаях приводит к образованию активного комплекса, в других – неактивного комплекса вследствие нарушения пространственного расположения функциональных групп активного центра в промежуточном комплексе.
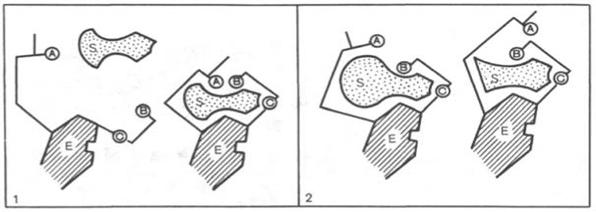
А, В, С - функциональные группы активного центра; 1 - активный комплекс; 2 - неактивный комплекс
Рисунок 15 - Изменения структуры активного центра фермента, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошленда.
В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Гипотеза «индуцированного соответствия» предполагает существование между ферментом и субстратом не только пространственной или геометрической комплементарности, но и электростатического соответствия, обусловленного спариванием противоположно заряженных групп субстрата и активного центра фермента. Точное соответствие обеспечивает образование эффективного комплекса между субстратом и ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Другими словами, это энергия, необходимая для запуска химической реакции, без которой реакция не начинается, несмотря на ее термодинамическую вероятность. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 16).
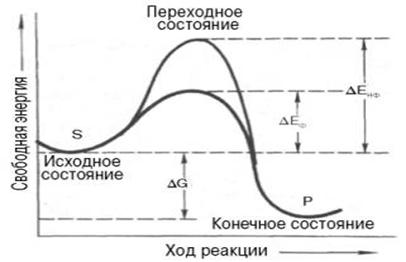
S - исходный субстрат; Р - продукт; ΔЕНФ -энергия активации неферментативной реакции; ΔЕФ - энергия активации ферментативной реакции; ΔG - стандартное изменение свободной энергии
Рисунок 16 - Энергетический механизм ферментативной и неферментативной химических реакций
На рисунке видно, что ферментативная реакция имеет более низкую энергию активации. Следует отметить, что как катализируемая ферментом, так и не катализируемая им реакция независимо от ее пути имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратной реакциями, как и не влияют на величину свободной энергии реакции; они лишь ускоряют наступление равновесия химической реакции.
Поможем написать любую работу на аналогичную тему

