В аналитической химии наибольшее значение имеют гетерогенные системы жидкость — твердая фаза и жидкость — жидкость.
Равновесие в гетерогенных системах подчиняется закону действия масс и количественно характеризуется константами равновесия, для системы жидкость — жидкость. и Произведением растворимости (ПР) для системы раствор — осадок. Так же как и в случае равновесия в гомогенной системе, равновесие в гетерогенной системе характеризуется термодинамической и концентрационной константами равновесия (реальной и условной)
Для равновесия осадок — раствор:
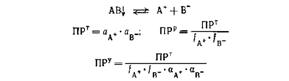
где ПРТ, ПРР — ПРу — термодинамическое, реальное и условное произведение растворимости; f — коэффициент активности; а — коэффициент, учитывающий влияние побочных (конкурирующих) реакций.
Для равновесия жидкость — жидкость, например вода — органический растворитель, не смешивающийся
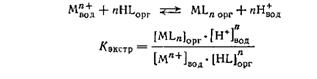 Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
![]()
Поможем написать любую работу на аналогичную тему

