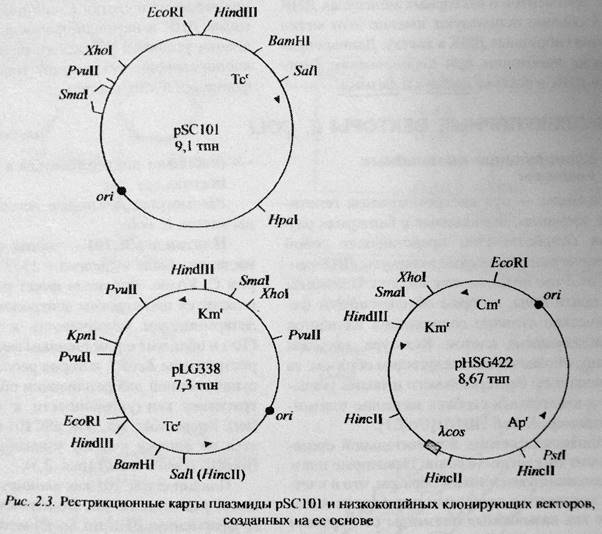
Культуры, несущие плазмиду, обозначаются следующим образом: E. coli HB101 – E. coli, штамм HB101, несущий плазмиду pSC101.
Репликация и соответственно, количество копий плазмид на клетку зависит от клетки-хозяина. Плазмиды со строгим контролем репликации присутствуют в виде одной или нескольких копий, находящиеся под ослабленным контролем репликации – имеют 10-200 копий на клетку. Если необходимо только клонирование, но не экспрессия фрагмента ДНК, то синтез белка в клетке блокируют хлорамфениколом, и количество копий одной плазмиды может быть увеличено до нескольких тысяч. В отсутствие биосинтеза белка репликация плазмид с ослабленным контролем продолжается, а репликация бактериальной хромосомы и плазмид со строгим контролем – прекращается.
Чтобы быть удобным вектором, плазмида должна:
(1) нести отбираемый маркер(ы) – для отбора трансформированных клеток из бактериальной популяции;
(2) нести предпочтительно по 1 месту расщепления одной или несколькими рестриктазами, причем в тех участках плазмиды, которые несущественны для ее репликации;
(3) быть небольшого размера и иметь ослабленный контроль репликации (если это клонирующий вектор);
(4) стабильно поддерживаться в клетках-реципиентах.
pSC101 - первая векторная плазмида E. coli (выделена в лаб. Коэна в 1973 г.). Имеет размер 9.1 тпн, находится под строгим контролем репликации, несет ген устойчивости к тетрациклину (tet), имеет один сайт узнавания для рестриктазы EcoRI. В самом гене tet имеется по одному участку узнавания HindIII, BamHI, SalI.
Эта плазмида активно использовалась ранее, но ныне не используется, т.к. имеет ряд недостатков как клонирующий вектор:
1) при встройке чужеродной ДНК по сайту рестрикции EcoRI не удается фенотипически отличить клетки бактерий, несущие исходную и гибридную плазмиды. Отбор клонов, несущих гибридную плазмиду, приходится осуществлять гибридизацией нуклеиновых кислот in situ;
2) встройка по сайтам HindIII, BamHI, SalI устраняет единственный фенотипический маркер;
3) находится под строгим контролем репликации (в клетке около 6 копий данной плазмиды).
Однако было установлено, что не все гены можно копировать в многокопийных векторах. Это связано с тем, что повышенная доза клонированного гена вызывает суперсинтез белка, а высокая концентрация некоторых регуляторных или структурных белков приводит к гибели клетки. Поэтому для клонирования таких генов подходят низкокопийные векторы. Подходящими низкокопийными векторами как раз являются векторы, производные от pSC101.
ColE1 – второй в истории вектор молекулярного клонирования после pSC101, размером 6.6 Кб. Плазмида имеет ослабленный контроль репликации: при обычных условиях роста в клетке имеется 20-30 копий. После обработки хлорамфениколом количество копий увеличивается до 1-3 тыс. При этом плазмидная ДНК составляет более половины всей ДНК клетки, что упрощает процедуру выделения и очистки плазмиды. В плазмиде имеется 1 сайт узнавания рестриктазой EcoRI. Плазмида обуславливает одновременно синтез в клетке колицина (содержит структурный ген колицина E1 cea) и иммунность к летальным дозам колицина.
A colicin is a type of bacteriocin produced by and toxic to some strains of Escherichia coli. Colicins are released into the environment to reduce competition from other bacterial strains. Colicins bind to outer membrane receptors, using them to translocate to the cytoplasm or cytoplasmic membrane, where they exert their cytotoxic effect, including depolarisation of the cytoplasmic membrane, DNase activity, RNase activity, or inhibition of murein synthesis.
Кроме этих трех генов, имеется еще ген, кодирующий белок Kil. Гены cea и kil образуют единый оперон. Белок Kil обуславливает высвобождение колицина E1 из бактерий в окружающую среду. При встройке экзогенных фрагментов ДНК по EcoRI-месту нарушается ген продукции колицина, но сохраняется ген иммунности к нему – это является основой для отбора трансформантов, содержащих гибридные плазмиды. Способ отбора таков:
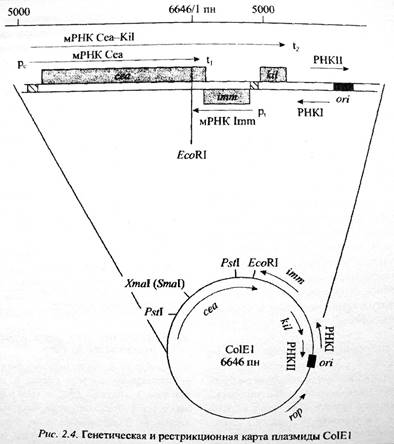
1) трансформантов высевают на среду, содержащую колицин E1; клетки, выросшие на такой среде, содержат либо исходную плазмиду ColE1, либо ее гибридные производные;
2) в другой ЧП равномерно засевают E. coli, чувствительную к колицину E1 (Cols) – получают газон;
3) колонии, устойчивые к колицину, перепечатывают единообразно на засеянную и незасеянную чашки;
4) на чашках с газоном E. coli Cols вокруг напечатанных сверху колоний, продуцирующих колицин, наблюдается кольцевая прозрачная зона, где рост газона отсутствует – такие клоны содержат нативную плазмиду ColE1. Другие клоны (выросшие на незасеянной чашке) содержат гибридные варианты ColE1, у которых в результате встройки чужДНК ген продукции колицина поврежден.
Недостаток такой фенотипической селекции в том, что бактериальные клетки могут приобретать устойчивость к колицину путем спонтанных мутаций.
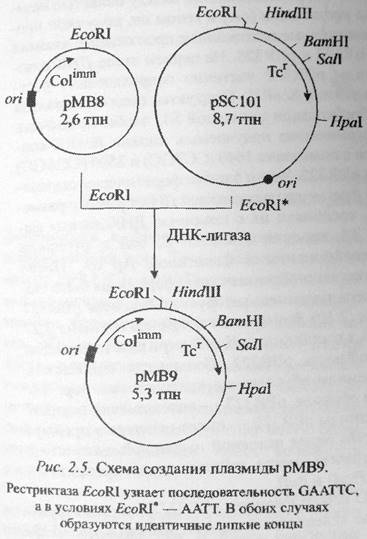
pMB8 – размер плазмиды – 2.6 тыс. п.н. Эта плазмида стала основой для разработки целой серии клонирующих векторов. Плазмида несет ген иммунности к колицину – придает клетке устойчивость к его летальным дозам (кодируя белок иммунности); плазмида имеет единственный сайт узнавания для EcoRI. Для отбора гибридных клонов бактерии высевают на чашки Петри со средой, содержащей колицин E1.
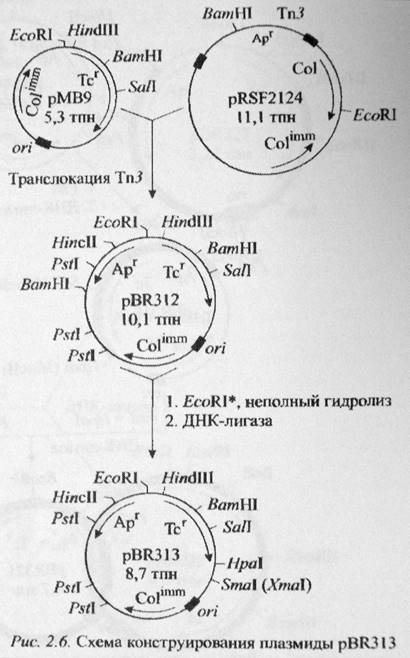
Плазмида pMB9 была сконструирована на путем гибридизации pMB8 и pSC101 – таким образом, в pMB9 был перенесен ген устойчивости к тетрациклину. Обе плазмиды были обработаны EcoRI и затем сшиты ДНК-лигазой, с последующим отбором трансформантов с фенотипом TcrColimm. Плазмида имеет размер 5.3 Кб и имеет места действия для четырех рестриктаз: EcoRI, HindIII, BamHI, SalI. При встройке чужеродной ДНК в местах узнавания 3-х последних рестриктаз нарушается ген устойчивости к тетрациклину. При встройке по EcoRI-сайту фенотипическую селекцию производить не удается.
pRSF2124 – плазмида размером 11.1 Kb, полученная в результате транслокации in vivo транспозона Tn3, несущего ген устойчивости к ампициллину, из плазмиды RI в плазмиду ColE1. Отбор гибридных клонов происходит по их устойчивости к ампициллину (маркер Apr). Единственное место узнавания рестриктазой EcoRI находится внутри гена синтеза колицина, и при встройке чужДНК по этому месту, клетка демонстрирует иммунитет к колицину, но отсутствие способности к его синтезу.
pBR322 – размером 4.36 Kb, наиболее удобный клонирующий вектор из тех, которыми трансформируют E. coli. Ее полная нуклеотидная последовательность известна, и поэтому легко локализовать места расщепления любой рестриктазой. Она имеет 2 селективных маркера: Apr и Tcr. Она имеет уникальные участки расщепления рестриктазами VspI, PstI, PvuI, ScaI, расположенные в гене бета-лактамазы. Места расщепления HindIII, EcoRV, BamHI, SalI, SphI, XmaIII, NruI локализованы в гене устойчивости к тетрациклину. Участок HindIII находится в промоторной области гена tet. Таким образом, после встройки чужДНК по указанным местам узнавания, отбор гибридных клонов происходит на средах с антибиотиками. За пределами генов устойчивости к антибиотиками находятся единственные места рестрикции для EcoRI, PvuII, BalI, AvaI, TthIII, SnaI, NdeI.
Создание плазмиды pBR322. Ряд плазмид E. coli имеют своего рода родословную. Путь конструирования pBR322 начался с участие pRSF2124 в pMB9 -> была получена плазмида pBR312, несущая маркеры Apr и Tcr. Из плазмиды pBR312 удалили одно из 2-х мест узнавания BamHI, и получили плазмиду pBR313. Затем через промежуточные плазмиды pBR318 и pBR320 получили pBR321, а случайную плазмиду с делецией, производную от pBR321, назвали pBR322. Таким образом, конструирование новых плазмид идет через перенос транспозонов, направленные делеции (для уменьшения размера плазмиды) и лигирования продуктов рестрикции плазмид.

Поможем написать любую работу на аналогичную тему

