F-плазмиды
F-плазмида, или F-фактор – это специальная конъюгативная плазмида. Конъюгация – перенос генетического материала между клетками прямым контактом или через специальный мостик. Открыта: Lederberg and Tatum в 1946 году. Подобная передача относится к горизонтальному переносу генов. The Fertility factor (first named F by its discoverer Esther Lederberg) was the first episome discovered. A common form of F factor is an F plasmid. Unlike other plasmids, F factor is constitutive for transfer proteins due to the gene traJ. The F plasmid belongs to a class of conjugative plasmids that control sexual functions of bacteria with a fertility inhibition (Fin) system. When an F+ cell conjugates/mates with an F− cell, the result is two F+ cells, both capable of transmitting the plasmid further by conjugation.
Коньюгацию у бактерий относят к аналогу полового воспроизведения у многоклеточных организмов, т.к. при этом происходит перенос генетического материала. Для передачи F-плазмиды клетка, уже имеющая такую плазмиду (донор), имеет специальные механизмы, распознающие что реципиентная клетка ее не имеет.
F-плазмида является эписомой, т.е. способна встраиваться в бактериальную хромосому. Длина F-плазмиды – около 100 Kb (тыс. п.о.). It carries its own origin of replication, the oriV – точку начала репликации, and an origin of transfer, or oriT – точку начала переноса. There can only be one copy of the F-plasmid in a given bacterium, either free or integrated, and bacteria that possess a copy are called F-positive or F-plus (denoted F+). Cells that lack F plasmids are called F-negative or F-minus (F-) and as such can function as recipient cells.
Among other genetic information the F-plasmid carries a tra and trb locus, which together are about 33 kb long and consist of about 40 genes.
The tra locus includes (1) the pilin gene and (2) regulatory genes, which together form pili on the cell surface. The locus also includes (3) the genes for the proteins that attach themselves to the surface of F- bacteria and initiate conjugation.
When conjugation is initiated by a signal the relaxase enzyme creates a nick in one of the strands of the conjugative plasmid at the oriT. Relaxase may work alone or in a complex of over a dozen proteins known collectively as a relaxosome. The nicked strand, or T-strand, is then unwound from the unbroken strand and transferred to the recipient cell in a 5'-terminus to 3'-terminus direction. The remaining strand is replicated either independent of conjugative action (vegetative replication beginning at the oriV) or in concert with conjugation (conjugative replication similar to the rolling circle replication of lambda phage).
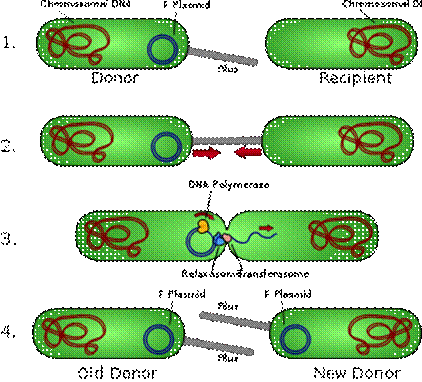
Schematic drawing of bacterial conjugation.
1 - Donor cell produces pilus.
2 - Pilus attaches to recipient cell and brings the two cells together.
3 - The mobile plasmid is nicked (образуется насечка) and a single strand of DNA is then transferred to the recipient cell.
4 - Both cells synthesize a complementary strand to produce a double stranded circular plasmid and also reproduce pili; both cells are now viable donors.
If the F-plasmid that is transferred has previously been integrated into the donor’s genome some of the donor’s chromosomal DNA may also be transferred with the plasmid DNA. The amount of chromosomal DNA that is transferred depends on how long the two conjugating bacteria remain in contact. In common laboratory strains of E. coli the transfer of the entire bacterial chromosome takes about 100 minutes. The transferred DNA can then be integrated into the recipient genome via homologous recombination.
A cell culture that contains in its population cells with non-integrated F-plasmids usually also contains a few cells that have accidentally integrated their plasmids. It is these cells that are responsible for the low-frequency chromosomal gene transfers that occur in such cultures. Because such strains transfer chromosomal genes very efficiently they are called Hfr (high frequency of recombination). The E. coli genome was originally mapped by interrupted mating experiments in which various Hfr cells in the process of conjugation were sheared from recipients after less than 100 minutes (фрагментация генома на F-плазмидах).
Искусственные бактериальные хромосомы - A bacterial artificial chromosome (BAC) is a DNA construct, based on a functional fertility plasmid (or F-plasmid), used for transforming and cloning in bacteria, usually E. coli. F-plasmids play a crucial role because they contain partition genes that promote the even distribution of plasmids after bacterial cell division. The bacterial artificial chromosome's usual insert size is 150-350 kbp. BACs are often used to sequence the genome of organisms in genome projects, for example the Human Genome Project.
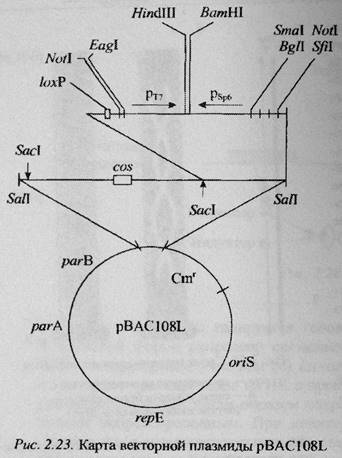
Векторы на основе полового фактора F (бактериальные искусственные хромосомы) были впервые применены в 1992 г. Шизуя и соавторами. Такие векторы позволяют клонировать фрагменты чужДНК размером до 300 т.п.н. Репликация F-плазмиды строго контролируется, и копийность составляет 1-2 копии на клетку. Плпзмида F несет на себе гены, не только регулирующие репликацию данной плазмиды, но ее копийность. Продукт гена repE контролирует однонаправленную репликацию F-плазмиды, начиная с района oriS. Гены parA и parB обеспечивают правильное распределение копий между делящимися клетками.
Вектор pBAC был создан на основе мини-F плазмиды pMBO131, в которую по сайту SalI был встроен фрагмент ДНК, содержащий участки cos фага лямбда и loxP фага P1. Этот же встроенный фрагмент содержал уникальные участки узнавания BamHI и HindIII, предназначенные для клонирования фрагментов ДНК, а также промоторы фагов T7 и Sp6, необходимые для синтеза in vitro радиоактивно или флуоресцентно меченных РНК-транскриптов (в качестве гибридизационных проб для «прогулки по хромосоме»).
По участку loxP такой вектор может быть расщеплен белком Cre фага P1, по cos-сайту – ферментом фага лямбда. Эти участки удобны для строго специфичного расщепления гибридных плазмид, мечения полученных концов и рестрикционного картирования клонированных фрагментов изучаемого генома.
Для изучения какого-либо генома его расщепляют HindIII, фракционируют в геле, веделяют фрагменты размером 100-300 тпн, и затем «сшивают» (лигируют) с плазмидой pBAC108L, расщепленной также по сайту HindIII. Полученные гибридные плазмиды вводили в клетку E. сoli электропорацией и отбирали клоны трансформантов по устойчивости к хлорамфениколу. После расщепления клонированных плазмид рестриктазой NotI и электрофореза можно установить размер встроенных фрагментов.
Пересевы трансформированных бактерий показали высокую стабильность встроек в BAC-векторах. В этом преимущество BAC-векторов по сравнению с высоко- и среднекопийными векторами, которым свойственна структурная нестабильность (например, в них происходят делеции). Поэтому BAC-векторы используются для создания библиотек фрагментов сложных геномов (геномов большого размера).
Поможем написать любую работу на аналогичную тему
Реферат
Векторы E. coli на основе F-плазмид (искусственные бактериальные хромосомы - BAC)
От 250 руб
Контрольная работа
Векторы E. coli на основе F-плазмид (искусственные бактериальные хромосомы - BAC)
От 250 руб
Курсовая работа
Векторы E. coli на основе F-плазмид (искусственные бактериальные хромосомы - BAC)
От 700 руб

