Два очень важных закона, известных как закон Бойля и закон Шарля, были открыты экспериментально. Их называют эмпирическими законами. Так, в 1662 году Р. Бойль измеряет степень сжатия атмосферного воздуха в U‑образной трубке, короткий конец которой был прокалиброван и запаян. В длинный конец можно было добавлять ртуть. Высота воздушного столба А была пропорциональна объему. Оказалось, что произведение Р´А было приблизительно постоянным. Р – высота ртутного столба. Из этого был сделан вывод, что при неизменной температуре
P1V1 = P2V2. (1.3)
Это и есть закон Бойля.
Закон Шарля (он одновременно был открыт Ж.Л. Гей-Люссаком) тоже был найден эмпирически. Сегодня он гласит:
В процессе охлаждения газа при постоянном давлении на каждый градус Цельсия его объем уменьшается на 1/273,15 того объема, который он занимает при 0 °С.
Математически это можно записать уравнением
![]() (при постоянном давлении). (1.4)
(при постоянном давлении). (1.4)
Чем интересно это уравнение? Оно указывает, что при t = -273,15 °С газ вообще должен исчезать, т.е. не занимать никакого объема. Это невероятно. Понятно, что это уравнение не может выполняться точно. Тем не менее температура -273,15 °С получила название абсолютного нуля. Абсолютный ноль использован в качестве точки отсчета в шкале Кельвина (или абсолютной шкале).
Приведенное выше уравнение можно записать так:
![]() , где T = t + 273,15. (1.5)
, где T = t + 273,15. (1.5)
При объединении законов Бойля и Шарля мы получим уравнение, которое позволяет характеризовать поведение газа при изменении всех трех параметров – температуры, давления, объема.
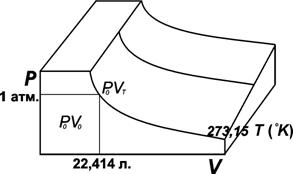
Рис. 1.1. PV-изотермы идеального газа
Точка P0V0 находится на изотерме (так называется кривая, полученная при одной и той же температуре), отвечающей 0 °С (рис. 1.1). В этой точке давление равно 1атм, а объем для газа равен 22,414 л. Этот объем при нормальных условиях (0 °С, 1 атм.) занимает 1 моль газа. Если двигаться по изобаре (т.е. по линии, соответствующей одному и тому же давлению), то эта траектория описывается уравнением Шарля
![]() .
.
Умножим обе части уравнения на Р0
![]() .
.
Но по закону Бойля
VТ Ро =Р V,
тогда
![]() (при постоянной температуре),
(при постоянной температуре),
т.е. если двигаться по изотерме.
Сейчас обозначим 273,15 как Т0 и получим хорошо известное уравнение, объединяющее уравнение Бойля и Шарля:
![]() . (1.6)
. (1.6)
Как мы уже видели, ![]() представляет собой постоянную величину, которая является коэффициентом пропорциональности, переводящим градусы абсолютной шкалы в единицы энергии. Действительно, PV имеет размерность энергии. Полученный коэффициент обозначают величиной R, и он носит название универсальной газовой постоянной. В результате мы получим уравнение идеального газа или уравнение Менделеева-Клайперона:
представляет собой постоянную величину, которая является коэффициентом пропорциональности, переводящим градусы абсолютной шкалы в единицы энергии. Действительно, PV имеет размерность энергии. Полученный коэффициент обозначают величиной R, и он носит название универсальной газовой постоянной. В результате мы получим уравнение идеального газа или уравнение Менделеева-Клайперона:
Р![]() = RТ (для 1 моля газа, где
= RТ (для 1 моля газа, где ![]() молярный объем), (1.7)
молярный объем), (1.7)
PV = nRT (для n молей газа). (1.8)
Название этого уравнения уже говорит о том, что оно верно для идеального газа и, наоборот, газ является идеальным, когда точно подчиняется этому уравнению. В реальном газе необходимо учитывать, что сами его молекулы занимают определенный объем. Кроме того, между молекулами газа имеются силы притяжения.
Рассмотрим первую часть уравнения. PV имеет размерность энергии. Действительно, допустим, что давление выражено в дин/см2, а объем в см3. Произведение PV имеет размерность дин/см, а это есть не что иное, как эрг, т.е. единица энергии в системе СГС (сантиметр/грамм/секунда). Аналогично PV можно выразить в Дж (система СИ)
В принципе энергию в любой форме можно представить в виде двух множителей: один из них будет фактором интенсивности, а другой – емкости.
Например, для уравнения идеального газа фактор интенсивности – это давление, а емкости – объем; в выражении кинетической энергии фактором емкости является масса, а половина квадрата скорости – интенсивность. В случае электрической энергии фактор емкости – это заряд, а фактор интенсивности – потенциал.
В принципе различные формы энергии легко можно переводить один в другой. Однако необходимо помнить, что ни в коем случае не допускается приравнивание друг к другу отдельных сомножителей, т.е. отдельно факторов интенсивности или факторов емкости.
Для того, чтобы отличать факторы емкости и факторы интенсивности, полезно помнить, что фактор интенсивности не зависит от размеров и протяженности системы.
Хотелось бы сказать, что коэффициент пропорциональности (R) очень удобен для перехода от одного типа энергии к другому. Более подробно мы с этим познакомимся на практических занятиях.
Здесь же укажем, что
R = 8,314 107 эрг/моль × град;
R = 8,314 Дж/моль×град;
R = 1,987 кал/моль×град.
Газовая постоянная тесно связана с теплоемкостью газов. Теплоемкость – это количество тепла, необходимое для повышения температуры вещества на 1°. Обычно речь идет о молярной теплоемкости, т.е. она относится к количеству вещества в один моль. Удельная теплоемкость относится к одному грамму, т.е. это количество тепла, необходимого для нагрева 1 г вещества на 1°. Количество тепла, необходимого для нагрева вещества, зависит не только от его массы, но и от условий нагрева. Поэтому различают молярную теплоемкость при постоянном объеме ![]() и при постоянном давлении
и при постоянном давлении ![]() . Для жидкостей и твердых тел
. Для жидкостей и твердых тел ![]() и
и ![]() практически одинаковы. Для газа
практически одинаковы. Для газа ![]() больше
больше ![]() на то количество тепла, которое затрачивается на расширение газа. Для одноатомных газов
на то количество тепла, которое затрачивается на расширение газа. Для одноатомных газов ![]() » 5 ккал/град, а
» 5 ккал/град, а ![]() » 1 кал/град. `
» 1 кал/град. `![]() –
–![]() = 2 кал/град » R. Для многоатомных такая зависимость не сохраняется. Обусловлено это тем, что подводимая энергия переходит не только в поступательную, но и в колебательную и вращательную энергию.
= 2 кал/град » R. Для многоатомных такая зависимость не сохраняется. Обусловлено это тем, что подводимая энергия переходит не только в поступательную, но и в колебательную и вращательную энергию.
Поможем написать любую работу на аналогичную тему

