Если система совершает работу W только против внешнего давления, то
W = РDV (2.3)
или для элементарного процесса
dW = pdV. (2.4)
Математическое выражение первого начала термодинамики вэтом случае имеет вид:
Q= DU + pD (2.5)
или
dQ = dU + pdV. (2.6)
Для изохорного процесса (V = const) pDV = 0 и следовательно:
QV = DU, (2.7)
dQV = dU, (2.8)
где QV – теплота, сообщаемая системе в изохорном процессе.
Из уравнений (2.7) и (2.8) следует, что в изохорном процессе тепло, сообщаемое системе, идет только на приращение внутренней энергии системы. В этом случае QV не зависит от пути перехода системы из одного состояния в другое и dQV является полным дифференциалом, т.е. функцией состояния.
Это означает, что изменение внутренней энергии системы DU в изохорном процессе определяется теплотой процесса QV и может быть измерено калориметрически.
В случае изобарного процесса (р= const)
QP = DU + PDV, (2.9)
Qp = U2 - U1 + pV2 -pV1, (2.10)
где QP – теплота, сообщаемая системе в изобарном процессе. Сгруппируем величины с одинаковыми индексами
QP = (U2 + PV2 ) - (U1+ PV1). (2.11)
Так как внутренняя энергия, объем системы и давление – функции состояния, то сумма величин U + pV также должна быть функцией состояния и ее изменение не зависит от пути перехода системы из одного состояния в другое.
Эту функцию состояния называют энтальпией и обозначают символом Н.
Н = U + pV. (2.12)
Из уравнений (2.11 ) и (2.12) следует, что
Qp = DН, (2.13)
dQр = dH. (2.14)
Таким образом, в изобарном процессе все тепло, сообщенное системе, идет на приращение ее энтальпии. В этом случае Qp также не зависит от пути перехода системы из одного состояния в другое и dQр является полным дифференциалом.
Из уравнений (2.13) и (2.14) следует также, что изменение энтальпии системы DН в изобарном процессе определяется теплотой процесса Qp и может быть измерено калориметрически.
В адиабатном процессе, т.е. в процессе, в котором система не обменивается с окружающей средой теплотой, работа совершается за счет уменьшения внутренней энергии системы:
Q = 0 , (2.15)
dQ = 0, (2.16)
W = - DU, (2.17)
dW = - dW. (2.18)
Изотермический процесс характеризуется T = const. для такого процесса dU = 0, тогда dQ = dWT, т.е. вся сообщенная системе теплота превращается в работу, величина которой определяется уравнениями
dWT = pdv, (2.19)
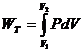 . (2.20)
. (2.20)
Используя уравнение состояния газа Менделеева-Клапейрона, найдем, что для 1 моль идеального газа
![]() ,
,
тогда
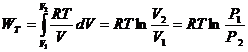 . (2.21)
. (2.21)
Поможем написать любую работу на аналогичную тему

