Первое начало термодинамики – это закон сохранения энергии. Он впервые четко сформулирован Г. Гельмгольцем в 1847 году. Этот закон не может быть четко доказан, но является результатом всего человеческого опыта. Такие законы часто называют законами природы. Известный математик А. Пуанкаре как-то иронически заметил, что в сущности все твердо верят в закон сохранения энергии потому, что математики принимают его за экспериментальный факт, а экспериментаторы считают его математической теоремой.
Есть несколько формулировок первого закона термодинамики. Если одна из них принимается в качестве основной, то все другие являются следствиями, вытекающими из нее.
Одна из формулировок звучит следующим образом: энергия не создается и не уничтожается. Возможны лишь превращения энергии из одного вида в другой в строго эквивалентных количествах.
Следствием из этого закона является вывод, что невозможен вечный двигатель первого рода, т.е. нельзя создать такой двигатель, который совершил бы работу без затраты энергии. Создание такого двигателя возможно только в том случае, если неверен первый закон.
Часто используется еще одна формулировка первого начала термодинамики: внутренняя энергии изолированной системы есть величина постоянная.
Если данной системе передается некоторое количество энергии в форме тепла Q, которое идет только на приращение внутренней энергии системы DU и на совершение системой работы W, то, согласно первому началу,
Q = DU + W, (2.1)
для бесконечно малых изменений
dQ = dU + dW. (2.2)
Уравнения (2.1) и (2.2) являются математическим выражением первого начала термодинамики.
Укажем, что DU и dU не зависят от пути перехода системы из начального состояния в конечное, т.е. внутренняя энергия является функцией состояния системы.
Справедливость этого утверждения можно доказать следующим образом (рис. 2.1).
Предположим, что в состоянии (I) внутренняя энергия системы U1. Из этого состояния система переходит в состояние (2), в котором ее внутренняя энергия равна U2.
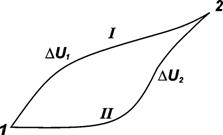
Рис. 2.1. Схематическое отображение путей перехода системы из состояния 1 в состояние 2 и обратно
При переходе системы из состояния 1 в состояние 2 по пути I обозначим изменение внутренней энергии системы как DU1, а по второму пути, – как DU2. Согласно первому закону, DU1 = DU2 . Если бы это равенство не соблюдалось, а, например, DU1 было бы больше DU2, то, переводя систему из состояния 1 в состояние 2 по пути I и обратно по пути II, можно было бы получать энергию из ничего. Это противоречит первому началу термодинамики.
В отличие от DU величины Q и W в общем случае зависят от пути процесса. Поэтому в уравнении (2.2) dU является полным дифференциалом, в то время как dQ и dW – просто бесконечно малыми величинами
Поможем написать любую работу на аналогичную тему

