Для необратимых круговых процессов выполняется неравенство Клаузиуса, а для обратимых круговых процессов выполняется равенство Клаузиуса: «Приведённое кол-во теплоты, полученное системой при любом квазистатическом круговом процессе, равно нулю».
Энтропия: Энтропия системы есть функция её состояния, определённая с точностью до произвольной постоянной. Разность энтропии в двух равновесных состояниях 2 и 1, по определению, равна приведённому кол-ву теплоты, которое надо сообщить системе, чтобы перевести её из состояния 1 в состояние 2 по любому квазистатическому пути.
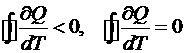
![]() – полный дифференциал
– полный дифференциал ![]()
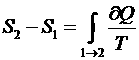 , где 1 – необратимый процесс, а 2 – обратимый
, где 1 – необратимый процесс, а 2 – обратимый
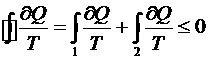
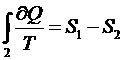 , т.к. процесс 2 – квазистатический.
, т.к. процесс 2 – квазистатический.
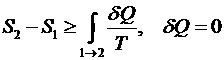 , т.к. процесс – адиабатический
, т.к. процесс – адиабатический
![]()
Закон возрастания энтропии: энтропия адиабатически изолированной системы не может убывать; она либо возрастает, либо остаётся постоянной.
Энтропия – аддитивная функция состояния. При расширении в пустоту энтропия увеличивается. Энтропия максимальна в состоянии равновесия.
Энтропия ![]() определяется логарифмом числа микросостояний, посредством которых реализуется рассматриваемое макросостояние:
определяется логарифмом числа микросостояний, посредством которых реализуется рассматриваемое макросостояние:
![]() – формула Больцмана.
– формула Больцмана.
Термодинамические потенциалы.
![]()
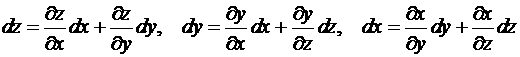
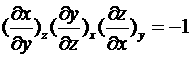 .
.
Если ![]() , то
, то
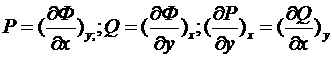
![]() – термодинамическое тождество.
– термодинамическое тождество.
Энтальпия: ![]()
Энтропия: ![]()
Свободная энергия: ![]()
Т/Д функция Гиббса: ![]()
![]()
![]()
![]()
![]()
Поможем написать любую работу на аналогичную тему

