Если посев может быть выполнен не ранее чем через 48 час. или при доставке проб в отдаленные лаборатории рекомендуют транспортные среды (например, силикагель или другие аналогичные, разрешенные к применению для этих целей в установленном порядке) или метод "полоски фильтровальной бумаги".
Для этих целей используют фильтровальную бумагу (ГОСТ 6246-71, ГОСТ 1202-76 или другую с аналогичными характеристиками, разрешенную к применению для этих целей в установленном порядке).
Исследование проводят в несколько этапов.
Фильтровальную бумагу нарезают полосками размером 2 х 6 см. На одну поверхность такой полоски наносят штрих простым карандашом.
Кальку, нарезанную предварительно полосками размером 3 х 15 см, сгибают поперек таким образом, чтобы одна часть ее оказалась на 5 мм длиннее другой.
Полоску фильтровальной бумаги карандашным штрихом книзу вкладывают в сгиб кальки так, чтобы более длинная часть ее накрывала фильтровальную бумагу сверху. Кальку с полоской фильтровальной бумаги упаковывают в двойной слой алюминиевой фольги размером 10, 5 х 19 см (алюминиевую фольгу толщиной 0,015 мм размером 10х20 см складывают вдвое для получения двухслойного квадрата) таким образом, чтобы она закрывалась со стороны более длинной части кальки и не отмеченной штрихом поверхности полоски фильтровальной бумаги. Такие упаковки вкладывают в конверты по 20 штук и стерилизуют в автоклаве при 118 ºС в течение 20 минут (в различных источниках цифры разные: при 121 ºС 30 мин; при 120 °С 40 минут). После высушивания их можно использовать в течение многих лет без дополнительной стерилизации, если упаковки сохраняются.
На алюминиевой фольге шариковой ручкой пишут фамилию, имя, отчество обследуемого, дату взятия материала. Фольгу разворачивают, приподнимают верхнюю часть кальки, взяв ее кончиками пальцев за самый край так, чтобы не коснуться полоски фильтровальной бумаги, и тампон, которым предварительно взят материал для исследования, с надавливанием перекатывают по поверхности фильтровальной бумаги, а затем его концом прикасаются к полоске в нескольких местах по периферии.
Полоску фильтровальной бумаги, покрытую калькой, после нанесения на нее материала с тампона оставляют на столе до полного высыхания на несколько минут (до 10-15). Достаточное высушивание полоски является основным условием сохранения жизнеспособности стрептококков.
После высушивания фольгу заворачивают и упаковки отправляют в лабораторию. Такие образцы можно посылать по почте в конвертах.
При хранении их в условиях комнатной температуры посев может быть отсрочен на 10-12 дней.
В лаборатории раскрывают фольгу, приподнимают край кальки и стерильным пинцетом переносят полоску фильтровальной бумаги на кровяной агар стороной, на которую нанесен материал с тампона, поверхностью с карандашным штрихом кверху. Таким образом, чашку Петри с кровяным агаром и полоской фильтровальной бумаги оставляют на 6 часов в термостате при 37 град. С. Затем стерильным пинцетом полоску осторожно снимают с первого участка инкубации, делают отпечаток на соседнем участке кровяного агара и сразу же переносят на третий участок, где оставляют на 16-18 часов в термостате при 37 град. С.
Результаты учитывают после удаления полосок фильтровальной бумаги.
Центр ВОЗ по изучению стрептококковых инфекций (Прага), разработавший этот метод, предложил пользоваться фильтровальной бумагой английского производства Whatman N 1.
В нашей стране также выпускается пригодная для данного метода бумага:
1. бумага промокательная ГОСТ 6246-71, масса 1 кв. м - 65 г, Лальская бумажная фабрика;
2. бумага фильтровальная ГОСТ 1202-76, Институт бумаги.
Учитывая, что в пробе материала, подлежащего микробиологическому исследованию, могут присутствовать другие патогенные или условно - патогенные микроорганизмы, в зависимости от предполагаемого диагноза и возможной этиологии болезни, необходимо для первичного посева использовать дополнительно соответствующие питательные среды (приказ N 535 от 22.04.1985 г.).
 |
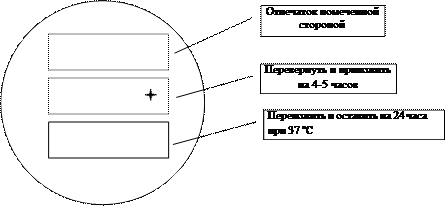
Затем все это упаковывается в алюминиевую фольгу в 1-2 слоя и края двойным швом защипываются.
120 °С 40 минут стерилизовать в автоклаве. Хранится стерильно до полугода.
На фольге хорошо пишет шариковая ручка.
Расщипывается край упаковки, расширяется пинцетом и тампоном прокатить по фильтровальной бумаге. Если тампон сухой – смочить. 10-12 минут выдержать открытым и запечатать. Может храниться 7-10 суток. Температура роли не играет.
2. использование в работе стандартных питательных сред.
На 1-м месте – кровяной агар.
Шоколадный агар – разрушаются М-антитела, но гемолиз не уловить. Пневмококк любит шоколадный агар.
Сывороточно-кровяной агар – хорошо для пневмококка. Оптимально – лошадиная сыворотка. Сыворотки не менее 10%, крови – 5%.
Сухая стрептококковая среда для выделения гемокультуры (Махачкала). Готовится на базе кровезаменителей (раствор гидролизина, гидролизата казеина и аминопептида) с истекшим сроком годности. По прописи получается бульон, добавляется агар (1,5-1,8% - требуется подтитровка в зависимости от серии). Если добавить 2-2,5% крови – можно уловить и гемолиз (при сниженной концентрации крови негативные факторы человеческой крови не чувствуются).
Среда Гаро (с генцианвиолетом, ингибирует стафилококки)
Желчно-кровяной агар (желчи 40%, в диске с желчью – 20%, в бульоне для пневмококков – 10%)
 |
Тип 1. мукоидные колонии. Глянцевые, блестящие как капля росы, выпуклые, с ровным краем, вязкой тягучей консистенции
Тип 2. шероховатые (matt) колонии. С изрезанным краем. Снимается вся сразу.
Тип 3. гладкие (glossy) колонии. Мелкие, блестящие, с ровным краем, но меньше, чем 1 и 2 типа
Str. pyogenes – тип колоний 1 и 2. Группа В – колонии чаще 3-го типа.
пневмококк
93 серотипа. По Лейнсфельд ни в одну серогруппу не входят.
Мукоидная форма – блюдцеобразная колония, блестящая, гладкая.
Шероховатая форма – морщинистая с изрезанным краем
Фантомные – при распаде matt-формы – осколки, обрывки, непонятные кусочки
Капсульные – тягучие, слизистые колонии
Пневмококк – в эксикаторе с СО2
До 9-11 серотипов пневмококков сменяют друг друга в каждом регионе в течение …
Посев на бульон для выделения чистой культуры. Глюкозный бульон – не лучший из-за образования кислоты и газа, что может ингибировать рост культуры.
Либо сывороточный бульон (10%), либо махачкалинский
Str. pyogenes – придонно-пристеночный рост. Чем мельче зерна, тем вирулентнее культура.
Пневмококк – рыхлый осадок.
Энтерококк – равномерное помутнение.
Лучше красить метиленовым синим – лучше видно, более щадящая окраска
СГД – стрептококки группы D. Str. bovis, Str. equines/
По данным ВОЗ в регионах с жарким климатом очень широко распространены поражения кожи стрептококковой этиологии
Роль энтерококков в инфекционной патологии человека сейчас возросла до невероятных размеров. Нагноения, раневые инфекции, отиты среднего уха (в бассейнах – до половины групп поражаются энтерококком - отиты), пародонтиты, свтоматологические остеопоражения, дыхательные пути, желчные пути, мочеполовой тракт, ОКИ, аппендициты, сепсис, эндокардит, внутриутробная инфекция плода, менингит новорожденных.
1896 г. первый санитарно-показательный микроорганизм – E. Coli была выделена.
В 30-е годы введен температурный тест Минкевича –43-44 °С. В остальных странах – 37 °С (в скандинавских странах – 38,5 °С).
В сточных водах БГКП не так показателен – теряется лактозный признак, да и глюкозный может не срабатывать (большое количество нефтепродуктов, целлюлозы и т.п.), поэтому энтерококк лучше, хотя в новых СанПиНах и МУКах их нет.
Для идентификации энтерококков служат биохимические тесты Шермена
Новая классификация разделила энтерококки на 2 группы – собственно энтерококки и СГД (в СГД всего 2 вида, Str. bovis – вызывает больше заболеваний у человека, чем Str. equinus).
Разница СГД и энтерококков в чувствительности (энтерококки более устойчивы к пенициллину, цефалоспоринам, аминогликозидам)
|
Фекальные стрептококки |
|||
|
энтерококки |
СГД |
||
|
Str. faecalis |
Str. faecium |
Str. bovis |
Str. equinus |
|
Большая устойчивость к Пенициллин, цефалоспорины, аминогликозиды |
β-гемолиз на кроличьей крови, α- и γ-гемолиз на бараньей крови |
||
Зеленящие стрептококки – включают несколько видов. α-гемолитические и негемолитические стрептококки.
Дифференциация групп зеленящих стрептококков
|
группа |
аргинин |
эскулин |
VP (ацетоин) |
маннит |
сорбит |
уреаза |
|
«Str. mutans» |
- |
+ |
+ |
+ |
+ |
- |
|
«Str. sangius» |
+ |
+ |
- |
- |
- |
- |
|
«Str. mitis» |
- |
- |
- |
- |
- |
- |
|
«Str. salivaris» |
- |
+ |
+ |
|
- |
V |
На 1-м месте по патологии - - группа «Str. mitis»
У зеленящих стрептококков недостаточное количество групповых специфических антигенов, поэтому в отдельную группу по Лейнсфельд они не выделены.
В отличие от пневмококка оптохинрезистентны и в желчи не растворимы. (пневмококк также дает α-гемолиз, но он абсолютно отдельно идет по классификации).
Поможем написать любую работу на аналогичную тему

